题目内容
【题目】“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH、HCOOH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。
(1)一定温度下,在两个容积均为2 L的密闭容器中,分别发生反应:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。相关数据如下:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2(g)和 3molH2(g) | 1mol CH3OH (g)和 1molH2O(g) |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出29.4kJ | 吸收a kJ |
请回答:
①a=_______________;
②若甲中反应10 s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是___________。
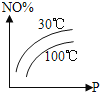
(2)甲烷的一个重要用途是制取H2,其原理为CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)。在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强p1_____(填“大于”或“小于”)p2;压强为p2时,在y点:v(正)______(填“大于”“小于”或“等于”)v(逆)。
2CO(g)+2H2(g)。在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强p1_____(填“大于”或“小于”)p2;压强为p2时,在y点:v(正)______(填“大于”“小于”或“等于”)v(逆)。

(3)一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) ΔH<0。在恒温恒容的密闭容器中通入n(NO)∶n(CO)=2∶1的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时刻一定达到平衡状态的是________(填字母)。
2CO2(g)+N2(g) ΔH<0。在恒温恒容的密闭容器中通入n(NO)∶n(CO)=2∶1的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时刻一定达到平衡状态的是________(填字母)。

【答案】19.6 0.03 mol·L-1·s-1 小于 大于 cd
【解析】
(1)①根据表格信息,1 mol CO2(g)、3 mol H2(g)与1 mol CH3OH(g)、1 mol H2O(g)属于“量相当”在相同条件下能建立相同的平衡状态,所以29.4+a=49.0,解得a=19.6;
②根据热化学方程式的意义,CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,平衡时放出29.4 kJ的热量,则反应掉的CO2=29.4/49=0.6 mol,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率=
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,平衡时放出29.4 kJ的热量,则反应掉的CO2=29.4/49=0.6 mol,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率=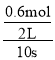 =0.03 mol·L-1·s-1;
=0.03 mol·L-1·s-1;
(2)根据化学反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g),增大压强,平衡逆向移动,甲烷的转化率降低,由图像可知,压强p1<p2,压强为p2时,在y点,可逆反应没有达到平衡,需升高甲烷的转化率,即平衡必须正向移动,则v(正)大于v(逆);
2CO(g)+2H2(g),增大压强,平衡逆向移动,甲烷的转化率降低,由图像可知,压强p1<p2,压强为p2时,在y点,可逆反应没有达到平衡,需升高甲烷的转化率,即平衡必须正向移动,则v(正)大于v(逆);
(3)a、平衡常数与温度有关,温度不变,则平衡常数始终不变,所以平衡常数不能判断是否达到平衡状态,选项a错误;
b、由图像可知,t1时刻CO2与NO物质的量相等,但是随后,它们的量继续发生变化,所以说明反应未达到平衡状态,选项b错误;
c、随着反应的进行,NO与CO的物质的量的比值在不断变化,当比值不变时,反应处于平衡状态,选项c正确;
d、随着反应的进行,NO和CO的转化率不断变化 ,当转化率不再变化时,说明反应处于平衡状态,选项d正确。
答案选cd。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案