题目内容
【题目】前四周期元素A、B、C、D、E的原子序数依次增大,A元素原子的核外电子只有一种运动状态;基态B原子s能级的电子总数比p能级的多1;基态C原子和基态E原子中成对电子数均是未成对电子数的3倍;D形成简单离子的半径在同周期元素形成的简单离子中最小。回答下列问题:
(1)元素A、B、C中,电负性最大的是____(填元素符号,下同),元素B、C、D第一电离能由大到小的顺序为________。
(2)与同族其它元素X形成的XA3相比,BA3易液化的原因是________;BA3分子中键角________109°28′(填“>”“<”或“=”),原因是________。
(3)BC3-离子中B原子轨道的杂化类型为____________,BC3-离子的立体构型为________________。
(4)基态E原子的电子排布式为________;C、E形成的化合物EC5(其中E的化合价为+6)中σ键与π键数目之比为________;
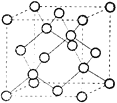
(5)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。若DB的晶胞参数为a pm,则晶体的密度为_____g·cm-3(用NA表示阿伏加德罗常数)。
【答案】O N>O>Al NH3分子间易形成氢键 < 孤电子对对成键电子对的排斥作用强于成键电子对之间的排斥作用 sp2 三角形 1s22s22p63s23p63d54s1(或[Ar] 3d54s1) 7:1 ![]() ×1030
×1030
【解析】
前四周期元素A、B、C、D、E的原子序数依次增大,A元素原子的核外电子只有一种运动状态,A为H元素;基态B原子s能级的电子总数比p能级的多1,核外电子排布为1s22s22p3,为N元素;基态C原子和基态E原子中成对电子数均是未成对电子数的3倍,核外电子排布为1s22s22p4、1s22s22p63s23p63d54s1,则C为O元素,E为Cr元素;D形成简单离子的半径在同周期元素形成的简单离子中最小,则D为该周期中原子序数最大的金属元素,因此D为Al元素。据此分析解答。
根据上述分析,A为H元素,B为N元素,C为O元素,D为Al元素,E为Cr元素。
(1)元素的非金属性越强,电负性越大,元素H、N、O中,电负性最大的是O元素;同一周期,从左到右,元素的第一电离能呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,同一主族,从上到下,第一电离能逐渐减小,
元素N、O、Al的第一电离能由大到小的顺序为N>O>Al,故答案为:O;N>O>Al;
(2)NH3分子间易形成氢键,导致氨气易液化;NH3中中心原子N的价层电子对数为4,孤电子对数为1,其VSEPR模型为四面体构型,NH3分子中N原子采用sp3杂化,为三角锥结构,孤电子对对成键电子对的排斥作用强于成键电子对之间的排斥作用,使得氨气分子中键角小于109°28′,故答案为:NH3分子间易形成氢键;<;孤电子对对成键电子对的排斥作用强于成键电子对之间的排斥作用;
(3)NO3-离子中N原子的价层电子对数=σ键电子对数+孤电子对数=3+![]() =3,采用sp2杂化,立体构型为三角形,故答案为:sp2;三角形;
=3,采用sp2杂化,立体构型为三角形,故答案为:sp2;三角形;
(4) E为Cr元素,基态E原子的电子排布式为1s22s22p63s23p63d54s1(或[Ar] 3d54s1);C、E形成的化合物CrO5(其中E的化合价为+6),结构为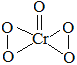 ,其中σ键与π键数目之比为7:1,故答案为:1s22s22p63s23p63d54s1(或[Ar] 3d54s1);7:1;
,其中σ键与π键数目之比为7:1,故答案为:1s22s22p63s23p63d54s1(或[Ar] 3d54s1);7:1;
(5)AlN晶胞中含有N或Al原子数为4,8×![]() +6×
+6×![]() =4,晶胞质量为
=4,晶胞质量为![]() g,因此晶胞的密度=
g,因此晶胞的密度= =
=![]() ×1030 g·cm-3,故答案为:
×1030 g·cm-3,故答案为:![]() ×1030。
×1030。

【题目】(I)俄美科学家联合小组宣布合成出114号元素(FI)的一种同位素,该原子的质量数是289,试回答下列问题:
(1)该元素在周期表中的位置______________,属于金属元素还是非金属元素?____
(2)如果该元素存在最高价氧化物对应的水化物,请写出其化学式___________________。
(II)下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:

(1)元素⑦的氢化物与⑧的单质反应的离子方程式为__________。
(2)元素②和⑤的最高价氧化物的水化物相互反应的化学方程式为___________。
(3)元素Fe的单质与⑦的氢化物高温下反应的化学方程式为___________。
(III)判断以下叙述正确的是__________。
部分短周期元素的原子半径及主要化合价
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.L2+、R2-的核外电子数相等
B.单质与稀盐酸反应的速率L<Q
C.M与T形成的化合物一定具有两性
D.氢化物的沸点为HnT>HnR
E. M的单质能与盐酸、NaOH溶液反应放出氢气