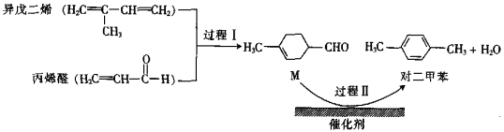
题目内容
【题目】重铬酸钾(K2Cr2O7)是工业上重要的氧化剂,实验室利用铬铁矿(主要成份为FeO·Cr2O3)模拟工业生产制备重铬酸钾的主要工艺如下:
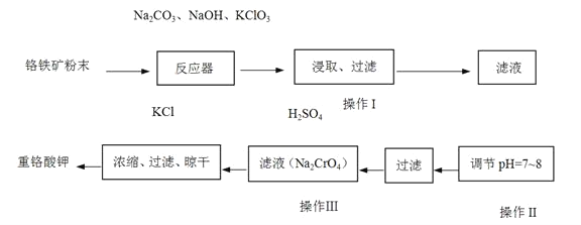
(1) 铬铁矿中的SiO2和Al2O3在反应器中与纯碱共热反应转变为可溶性盐,写出Al2O3与碳酸钠反应的化学方程式:_________。
(2)反应器中发生的主要反应为: 6FeO·Cr2O3+24NaOH+7KClO312Na2CrO4+3Fe2O3+7KCl+12H2O。Fe2O3可进一步转化为NaFeO2。NaFeO2在操作Ⅰ中强烈水解,写出NaFeO2水解的化学方程式:_________。
(3)操作Ⅱ的目的是_________。
(4)操作Ⅰ中CrO42-转化为Cr2O72-,写出此可逆反应的离子方程式:_________
(5)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2mol·L-1H2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol·L-1Na2S2O3标准溶液滴定至滴定终点时用去Na2S2O3溶液40.00mL(I2+2S2O32-=2I-+S4O62-)。
①写出重铬酸钾与碘化钾反应的离子方程式:_________;
②重铬酸钾试样的纯度(设整个过程中其它杂质不参与反应)为_________。
【答案】Al2O3+ Na2CO3![]() 2NaAlO2+CO2↑ NaFeO2+ 2H2O=Fe(OH)3↓ + NaOH 除去SiO32-和AlO2- 2CrO42-+2H+
2NaAlO2+CO2↑ NaFeO2+ 2H2O=Fe(OH)3↓ + NaOH 除去SiO32-和AlO2- 2CrO42-+2H+![]() Cr2O72-+H2O Cr2O72-+6I-+14 H+=2Cr3++ 3I2+ 7H2O 94.08%
Cr2O72-+H2O Cr2O72-+6I-+14 H+=2Cr3++ 3I2+ 7H2O 94.08%
【解析】
(1)Al2O3与碳酸钠的反应可以参照玻璃熔炉中SiO2与纯碱的反应,即生成NaAlO2和CO2,化学方程式为:Al2O3+ Na2CO3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
(2)NaFeO2的强烈水解即NaFeO2电离的FeO2-离子结合水电离出的H+离子转化为Fe(OH)3沉淀,NaFeO2电离的Na+离子结合水电离出的OH-离子生成NaOH的过程,因此化学方程式为NaFeO2+ 2H2O=Fe(OH)3↓ + NaOH;
(3) 操作Ⅱ是调节pH=7~8,之后是过滤,因此目的是除去Na2CrO4中的杂质离子,由前面的流程中可知,Fe元素已经转化为Fe(OH)3沉淀,因此杂质是Si元素的SiO32-和Al元素的AlO2-;
(4) CrO42-转化为Cr2O72-,由Cr元素的价态都为+6价可知该可逆反应是非氧化还原反应,离子方程式为:2CrO42-+2H+![]() Cr2O72-+H2O;
Cr2O72-+H2O;
(5)重铬酸钾中铬的还原产物为Cr3+,根据化合价的变化,碘化钾中I-被氧化成I2,介质是H2SO4,根据得失电子守恒和电荷守恒,该离子方程式为:Cr2O72-+6I-+14 H+=2Cr3++ 3I2+ 7H2O;依据反应方程式,各物质的量比关系为:Cr2O72-~3I2~6S2O32-,n(S2O32-)=0.1200 mol·L-1×0.040 L=0.0048 mol,推出n(Cr2O72-)=0.0048 mol÷6=0.0008 mol,原试样中的n(Cr2O72-)=0.0008 mol×250mL÷25.00mL=0.008 mol;m(K2Cr2O7)=0.008 mol×294 g/mol=2.352 g;ω(K2Cr2O7)=2.352 g÷2.5000g=94.08%。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案