题目内容
【题目】A、B、C、D、E是元素周期表中五种常见元素,其原子序数依次增大。详细信息见表:
① | A的一种核素在考古时常用来鉴定一些文物的年代 |
② | B的氧化物是导致光化学烟雾的主要物质之一 |
③ | C的某一种单质是空气的主要成分之一 |
④ | D的基态原子核外有6个原子轨道处于半充满状态 |
⑤ | E能形成红色的E2O和黑色的EO两种氧化物 |
请回答下列问题:
(1)D的价电子排布式可表示为__。
(2)BC3-的空间构型为__(用文字描述)。
(3)根据等电子原理,AC分子的结构式为__。
(4)1molAC2中σ键、π键数目之比为__。
(5)A、B、C的第一电离能由大到小顺序为__。
(6)E为__堆积金属,已知E原子的半径为acm,阿伏加德罗常数的值为NA,则E晶体的密度是__g·cm-3。(列出算式即可)。
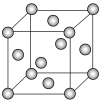
(7)E晶胞结构如图所示,E晶体中每个E原子周围距离最近的E原子数目为__;E2S为半导体材料,在其立方晶胞内部有4个S原子,其余S原子位于面心和顶点,则该晶胞中有__个E原子。
(8)将E单质的粉末加入NH3的浓溶液中,通入O2,充分反应后溶液呈深蓝色,写出该反应的离子方程式__。
【答案】3d54s1 平面三角形 C≡O 1∶1 N>O>C 面心立方 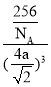 12 16 2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O
12 16 2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O
【解析】
A的一种核素在考古时常用来鉴定一些文物的年代,A是C元素;B的氧化物是导致光化学烟雾的主要物质之一,B是N元素;C的某一种单质是空气的主要成分之一,C是O元素;D的基态原子核外有6个原子轨道处于半充满状态,D为Cr元素;E能形成红色的E2O和黑色的EO两种氧化物,E是Cu元素。据此解答。
(1)Cr是24号元素,根据洪特规则,Cr的价电子排布式为3d54s1;
(2)根据价层电子对互斥理论,NO3-中心N原子的孤电子对数为0,价层电子对数为3,所以NO![]() 的空间构型为平面三角形;
的空间构型为平面三角形;
(3)CO与N2互为等电子体,N2的结构为N≡N,则CO的结构式为C≡O;
(4)双键中有1个σ键和1个π键,CO2的结构式是O=C=O,1个CO2中含有2个σ键,2个π键,二者数目之比是1:1;
(5)同周期元素从左到右第一电离能增大,N的2p轨道半充满,为稳定结构,C、N、O的第一电离能由大到小顺序为N>O>C;
(6)根据铜的晶胞结构,铜是面心立方堆积;Cu原子的半径为acm,则晶胞的对角线为4acm,则晶胞边长为![]() cm,晶胞体积V=(
cm,晶胞体积V=(![]() cm)3,每个晶胞中含有4个铜原子,故晶体密度ρ=
cm)3,每个晶胞中含有4个铜原子,故晶体密度ρ=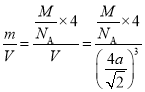 =
=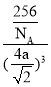 g·cm-3;
g·cm-3;
(7)根据铜的晶胞结构,每个Cu原子周围距离最近的Cu原子数目为12;根据题意,Cu2S晶胞中含有的S原子数为8×1/8+6×1/2+4=8,故该晶胞中含有的Cu原子数为16;
(8)将Cu单质的粉末加入NH3的浓溶液中,通入O2,充分反应后溶液呈深蓝色生成[Cu(NH3)4]2+,该反应的离子方程式是2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案