题目内容
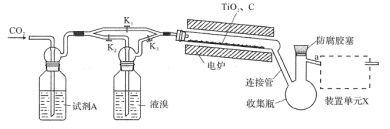
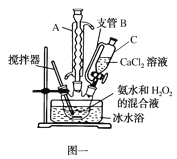
【题目】过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图(图一)如图:

已知:CaO2的制备原理:CaCl2+H2O2+2NH3·H2O+6H2O=CaO2·8H2O↓+2NH4Cl
请回答下列问题:
(1)仪器C的名称为__,支管B的作用__。
(2)加入氨水的作用是__。(从化学平衡移动的原理分析)
(3)过滤后洗涤沉淀的试剂最好用___。
A.水 B.浓盐酸 C.无水乙醇 D.CaCl2溶液
(4)沉淀反应时常用冰水浴控制温度在0℃左右,其可能原因是__、__(写出两种)。
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体):
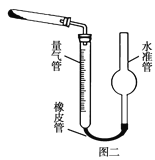
①检查该装置气密性的方法是:__。
②准确称取0.50g样品,置于试管中加热使其完全分解,收集到44.80mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为__(保留4位有效数字)。
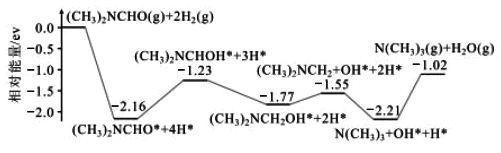
【答案】恒压滴液漏斗或恒压分液漏斗 平衡气压,便于恒压滴液漏斗中的液体能够顺利滴下 CaCl2+H2O2![]() CaO2+2HCl,加入氨水与氯化氢发生中和反应,使该可逆反应向着生成CaO2的方向移动,提高CaO2的产率 C 防止氨水挥发 防止过氧化氢分解 连接好装置,向水准管中注水至液面与量气管中形成液面差,静置一段时间,若液面差保持不变,则装置不漏气,反之装置漏气 57.60%或0.5760
CaO2+2HCl,加入氨水与氯化氢发生中和反应,使该可逆反应向着生成CaO2的方向移动,提高CaO2的产率 C 防止氨水挥发 防止过氧化氢分解 连接好装置,向水准管中注水至液面与量气管中形成液面差,静置一段时间,若液面差保持不变,则装置不漏气,反之装置漏气 57.60%或0.5760
【解析】
(1)根据装置图分析仪器C的名称;
(2)根据平衡移动原理分析;
(3)根据CaO2难溶于水、可与水缓慢反应,CaO2不溶于醇类、乙醚等分析;
(4)根据氨水挥发、过氧化氢易分解回答;
(5)利用反应2CaO2![]() 2CaO+O2↑计算CaO2纯度。
2CaO+O2↑计算CaO2纯度。
(1)仪器C的名称为恒压滴液漏斗或恒压分液漏斗,支管B的作用是平衡气压,便于漏斗中液体顺利流下;
(2)由于CaCl2+H2O2![]() CaO2+2HCl,加入氨水与HCl反应,促使平衡正向移动,提高CaO2产率;
CaO2+2HCl,加入氨水与HCl反应,促使平衡正向移动,提高CaO2产率;
(3)A.CaO2能潮解可与水缓慢反应,故不选A;
B.CaO2易与酸发生反应,故不选B;
C.CaO2不溶于醇类,故选C;
D.CaCl2溶液也含有水,CaO2可与水缓慢反应,故不选D;
(4)沉淀反应时常用冰水浴控制温度在0℃左右,原因可能是防止氨水挥发或防止过氧化氢分解;
(5)①检查装置气密性方法是:连接好装置,向水准管中注水至液面与量气管中形成高度差,静置一段时间,若高度差保持不变,则装置不漏气,反之装置漏气;
②样品质量为0.50g,置于试管中加热使其完全分解,收集到44.80mL(标况)气体,根据反应2CaO2![]() 2CaO+O2↑,则产品中过氧化钙的质量分数为
2CaO+O2↑,则产品中过氧化钙的质量分数为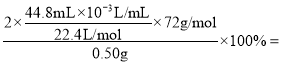 57.60%。
57.60%。

 阅读快车系列答案
阅读快车系列答案【题目】A、B、C、D、E是元素周期表中五种常见元素,其原子序数依次增大。详细信息见表:
① | A的一种核素在考古时常用来鉴定一些文物的年代 |
② | B的氧化物是导致光化学烟雾的主要物质之一 |
③ | C的某一种单质是空气的主要成分之一 |
④ | D的基态原子核外有6个原子轨道处于半充满状态 |
⑤ | E能形成红色的E2O和黑色的EO两种氧化物 |
请回答下列问题:
(1)D的价电子排布式可表示为__。
(2)BC3-的空间构型为__(用文字描述)。
(3)根据等电子原理,AC分子的结构式为__。
(4)1molAC2中σ键、π键数目之比为__。
(5)A、B、C的第一电离能由大到小顺序为__。
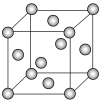
(6)E为__堆积金属,已知E原子的半径为acm,阿伏加德罗常数的值为NA,则E晶体的密度是__g·cm-3。(列出算式即可)。
(7)E晶胞结构如图所示,E晶体中每个E原子周围距离最近的E原子数目为__;E2S为半导体材料,在其立方晶胞内部有4个S原子,其余S原子位于面心和顶点,则该晶胞中有__个E原子。
(8)将E单质的粉末加入NH3的浓溶液中,通入O2,充分反应后溶液呈深蓝色,写出该反应的离子方程式__。
【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D