题目内容
6.按要求填空.(1)某温度下,纯水中c(H+)=2.0×10-6mol•L-1,则此时c(OH-)=2.0×10-6mol•L-1.若温度不变,滴入盐酸使c(OH-)=8.0×10-7mol•L-1,则c(H+)=5.0×10-6mol•L-1.
(2)室温下,将pH=10的NaOH溶液aL与pH=1的稀硫酸bL混合,(设混合后溶液体积的微小变化忽略不计),若所得混合液为中性,则a:b=1:1000;若所得混合液pH=3,则a:b=990:11.
(3)室温时,将PH=4的H2SO4溶液稀释10倍,则C(H+):C(SO42-)=2:1;若再将稀释后的溶液再稀释1000倍,则C(H+):C(SO42-)=20:1.
分析 (1)纯水中c(H+)=c(OH-),根据Kw=c(H+)×c(OH-)计算水的离子积,再计算滴入盐酸后溶液中c(H+);
(2)室温下,将pH=10的NaOH溶液aL与pH=1的稀硫酸bL混合,若所得混合液为中性,则n(H+)=n(OH-),若所得混合液pH=3,溶液呈酸性,表示出剩余氢离子浓度,结合溶液pH解答;
(3)硫酸溶液pH=4,溶液中c(SO42-)=$\frac{1}{2}$c(H+),将pH=4的H2SO4稀释10倍,溶液中的氢离子和硫酸根离子同等倍数的减小;
再稀释1000倍,相当于原溶液稀释10000倍,此时溶液接近中性,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而稀释过程中硫酸根的物质的量不变,计算稀释后溶液中硫酸根的物质的量浓度.
解答 解:(1)某温度下,纯水中的c(H+)=2.0×10-6mol•L-1,由于H2O?OH-+H+,则c(OH-)=c(H+)=2.0×10-6mol•L-1,若温度不变,Kw=c(OH-)×c(H+)=4.0×10-12(mol•L-1)2,滴入稀盐酸使c(OH-)=8.0×10-7mol/L,则溶液中c(H+)=$\frac{4×1{0}^{-12}}{8×1{0}^{-7}}$mol•L-1=5×10-6mol•L-1,
故答案为:2.0×10-6;5.0×10-6;
(2)室温下,将pH=10的NaOH溶液aL与pH=1的稀硫酸bL混合,若所得混合液为中性,则n(H+)=n(OH-),故aL×$\frac{1{0}^{-14}}{1{0}^{-10}}$mol/L=bL×0.1mol/L,整理可得a:b=1:1000;
若所得混合液pH=3,溶液呈酸性,则(bL×0.1mol/L-aL×$\frac{1{0}^{-14}}{1{0}^{-10}}$mol/L)÷(a+b)L=10-3mol•L-1,整理可得:a:b=990:11,
故答案为:1:1000;990:11;
(3)pH为4的溶液中氢离子浓度为:c(H+)=1×10-4mol/L,硫酸根离子的浓度为:c(SO42-)=$\frac{1}{2}$c(H+)=$\frac{1}{2}$×1×10-4mol/L=5×10-5mol/L;
将pH=4的H2SO4稀释10倍,溶液中的氢离子和硫酸根离子同等倍数的减小,则c(H+):c(SO42-)=2:1,稀释过程中硫酸的物质的量不变,溶液再稀释1000倍,相当于原溶液稀释10000倍后,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而硫酸根离子浓度为c(SO42-)=5×10-5mol/L×$\frac{1}{10000}$=5×10-9mol/L,则c(H+):c(SO42-)=1×10-7mol/L:5×10-9mol/L=20:1,
故答案为:2:1;20:1.
点评 本题考查有关pH值计算,注意掌握溶液酸碱性与溶液pH的关系,注意酸碱稀释接近中性应考虑水的电离,题目难度中等.

| A. | 工业上通过氧化法提取海水中的溴 | |
| B. | 工业上电解氯化钠溶液制取单质钠 | |
| C. | 工业利用冷却结晶法提取海水中的食盐 | |
| D. | 利用过滤法除去海水中的杂质生产淡水 |
| A. | 氨水 | B. | 浓硫酸 | C. | 饱和氯化钠溶液 | D. | 饱和石灰水 |
| A. | 氢氧化钠与稀硫酸反应 | B. | 灼热的炭与水蒸气反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl的反应 | D. | 甲烷在O2中的燃烧 |
| A. | 水电离的c(H+)=1×10-12mol•L-1的溶液中:K+、Na+、AlO2-、Cl- | |
| B. | 使石蕊变红色的溶液中:Na+、Al3+、SO42-、CO32- | |
| C. | Kw/C(H+)=1×10-13mol•L-1的溶液中:NH4+、Fe3+、Cl-、NO3- | |
| D. | 与Al反应能放出H2的溶液中:Na+、K+、NO3-、SO42- |
| A. | K+、H+、Cl-、CO32- | B. | Fe2+、Al3+、Cl-、SO42- | ||
| C. | Na+、Cu2+、NO3-、OH- | D. | NH4+、Ba2+、CO32-、OH- |
Fe3+→Fe2+ MnO4-→Mn2+ Cr2O72-→Cr3+ HNO3→NO
如果分别用上述这些物质氧化KI得到等量的I2,消耗物质的量最少的物质是( )
| A. | Fe3+ | B. | MnO4- | C. | Cr2O72- | D. | HNO3 |
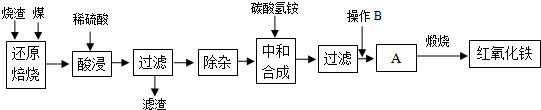
(1)在“还原焙烧”中产生的有毒气体可能有CO、SO2等.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是4Fe2++O2+4H+=4Fe3++2H2O(用离子方程式表示).
(3)根据下表数据:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 3.68 | 9.61 |
Fe3+已经除尽的试剂是KSCN溶液.
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则操作B是洗涤、干燥.
(5)煅烧A的反应方程式是4FeCO3+O2$\frac{\underline{\;煅烧\;}}{\;}$2Fe2O3+4CO2.
(6)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于$\frac{7b×98%}{10a}$(用含a、b的表达式表示).