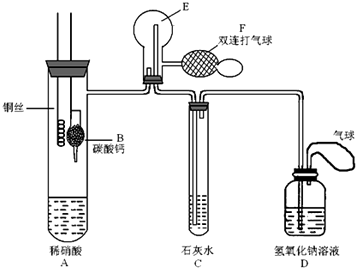
题目内容
7.用1L 1mol•L-1NaOH溶液吸收0.8molCO2,所得溶液中n(Na2CO3)和n(NaHCO3)之比约为( )| A. | 1:3 | B. | 3:1 | C. | 2:3 | D. | 3:2 |
分析 用1L 1mol•L-1NaOH溶液吸收0.8molCO2,生成Na2CO3和NaHCO3,则NaOH、CO2完全反应,令Na2CO3和NaHCO3的物质的量分别为xmol、ymol,根据钠离子、碳原子守恒列方程计算x、y的值,据此解答.
解答 解:用1L 1mol•L-1NaOH溶液吸收0.8molCO2,生成Na2CO3和NaHCO3,则NaOH、CO2完全反应,
令Na2CO3和NaHCO3的物质的量分别为xmol、ymol,
根据钠离子守恒有:2x+y=1×1
根据碳原子守恒有:x+y=0.8
联立方程,解得x=0.2,y=0.6
故所得溶液中Na2CO3和NaHCO3的物质的量之比约为0.2mol:0.6mol=1:3,
故选A.
点评 本题考查根据方程式的有关计算,难度不大,清楚发生的反应是关键,注意利用守恒思想进行的解答.

练习册系列答案
相关题目
17.要想除去氯气中含有少量的氯化氢气体最好让气体通过( )
| A. | 氨水 | B. | 浓硫酸 | C. | 饱和氯化钠溶液 | D. | 饱和石灰水 |
18.已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
Fe3+→Fe2+ MnO4-→Mn2+ Cr2O72-→Cr3+ HNO3→NO
如果分别用上述这些物质氧化KI得到等量的I2,消耗物质的量最少的物质是( )
Fe3+→Fe2+ MnO4-→Mn2+ Cr2O72-→Cr3+ HNO3→NO
如果分别用上述这些物质氧化KI得到等量的I2,消耗物质的量最少的物质是( )
| A. | Fe3+ | B. | MnO4- | C. | Cr2O72- | D. | HNO3 |
4.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、A12O3等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
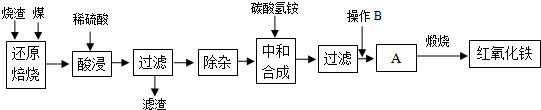
(1)在“还原焙烧”中产生的有毒气体可能有CO、SO2等.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是4Fe2++O2+4H+=4Fe3++2H2O(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于7.11,检验
Fe3+已经除尽的试剂是KSCN溶液.
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则操作B是洗涤、干燥.
(5)煅烧A的反应方程式是4FeCO3+O2$\frac{\underline{\;煅烧\;}}{\;}$2Fe2O3+4CO2.
(6)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于$\frac{7b×98%}{10a}$(用含a、b的表达式表示).

(1)在“还原焙烧”中产生的有毒气体可能有CO、SO2等.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是4Fe2++O2+4H+=4Fe3++2H2O(用离子方程式表示).
(3)根据下表数据:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 3.68 | 9.61 |
Fe3+已经除尽的试剂是KSCN溶液.
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则操作B是洗涤、干燥.
(5)煅烧A的反应方程式是4FeCO3+O2$\frac{\underline{\;煅烧\;}}{\;}$2Fe2O3+4CO2.
(6)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于$\frac{7b×98%}{10a}$(用含a、b的表达式表示).
5.短周期原子序数依次增大的主族元素R、T、Q、W、Y具有如下信息:①R、Y原子的最外层电子数与电子层数相同;②Q的最外层电子数是次外层的3倍,R与T的核电荷数之和等于Q的核电荷数;③W与R最外层电子数相同.下列说法正确的是( )
| A. | 元素T、Q、W、Y的原子半径大小为:T<Q<Y<W | |
| B. | 元素Q与W形成的两种常见化合物中含有相同比例的阴、阳离子 | |
| C. | Q与Y组成的常见物质是一种两性物质,结构中含有共价键 | |
| D. | 由Y和T组成的物质YT,在电子和陶瓷工业上有广泛应用,可以直接由单质Y和T在低温下合成 |
 ,用单线桥法分析上述反应.
,用单线桥法分析上述反应.