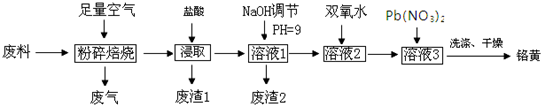
题目内容
15.镁及其合金是一种用途很广的金属材料,海水中镁的含量为1.10mg•L-1,目前世界上60%的镁是从海水中提取的.主要步骤如下: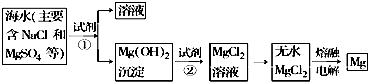
(1)为了使MgSO4完全转化为Mg(OH)2,可以加入过量试剂①,试剂①最好选用石灰乳.(填写名称)
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的操作方法是过滤.
(3)试剂②可以选用盐酸,其反应的离子方程式为Mg(OH)2+2 H+═Mg2++2H2O.
(4)无水MgCl2在熔融状态下,通电后会产生Cl2和Mg,写出该反应的化学方程式:MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
分析 由分离流程可知,试剂①将镁离子转化为沉淀,且不引入新杂质,则①为NaOH,由转化可知,试剂②为盐酸,然后在HCl气流中蒸发得到无水氯化镁,最后电解熔融氯化镁得到Mg,
(1)利用复分解反应及MgSO4转化为Mg(OH)2时阴离子的变化来选择试剂;
(2)分离固体和液体用过滤,利用溶解性的差异来分析,分离固体和液体用过滤;
(3)根据框图从氢氧化镁到氯化镁的反应分析,氢氧化镁和盐酸反应得到氯化镁和水;
(4)根据题目中提供的反应物和生成物解答,氯化镁电解为分解反应,产物为镁和氯气.
解答 解:(1)使MgSO4转化为Mg(OH)2,应选择碱石灰乳,MgSO4与Ca(OH)2反应生成了Mg(OH)2和CaSO4,方程式为:MgSO4+Ca(OH)2=Mg(OH)2↓+CaSO4,离子方程式:Mg2++2OH-═Mg(OH)2↓,为了使镁离子完全转化,加入试剂①的量应过量,
故答案为:石灰乳;
(2)过滤适用于不溶于水的固体和液体,分离固体和液体用过滤,所以分离得到Mg(OH)2沉淀的方法是过滤,故答案为:过滤;
(3)从氢氧化镁到氯化镁,氢氧化镁和盐酸反应得到氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,所以离子方程式为Mg(OH)2+2H+=Mg2++2H2O,
故答案为:盐酸;Mg(OH)2+2H+=Mg2++2H2O;
(4)氯化镁电解为分解反应,产物为镁和氯气,反应的化学方程式为:MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,
故答案为:MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
点评 本题考查了从海水中提取镁的反应原理,利用所学知识结合流程图信息是解答本题的关键,难度中等.

| A. | 第ⅠA族元素都是典型的金属元素 | |
| B. | 第三周期的元素的原子核外都有三个电子层 | |
| C. | F、Cl、O、N四种元素都是第ⅦA族的元素 | |
| D. | 原子的最外层有两个电子的元素都在第ⅡA族 |
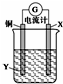
| A. | X可以是银或石墨 | B. | 电子从铜电极经外电路流向X电极 | ||
| C. | Y是硫酸铜溶液 | D. | X极上的电极反应式为Ag++e-═Ag |
 金属锡的冶炼常用焦炭作还原剂:SnO2(s)+2C(s)═Sn(s)+2CO(g),反应过程中能量的变化如图所示.下列有关该反应的△H、△S的说法中正确的是( )
金属锡的冶炼常用焦炭作还原剂:SnO2(s)+2C(s)═Sn(s)+2CO(g),反应过程中能量的变化如图所示.下列有关该反应的△H、△S的说法中正确的是( )| A. | △H<0△S<0 | B. | △H>0△S<0 | C. | △H<0△S>0 | D. | △H>0△S>0 |

 .
. +(n-1)H2O
+(n-1)H2O