题目内容
11.t℃时,将3 mol A和1 mol B气体通入容积为2L的密闭容器中,一定温度下发生反应:3A(g)十B(g)?4C(g),2 min时反应到达平衡状态,此时测得容器内B为0.8mol.请计算:(1)A的转化率a=20%
(2)该温度下的平衡常数K(写出必要的步骤).
分析 t℃时,将3 mol A和1 mol B气体通入容积为2L的密闭容器中,2 min时反应到达平衡状态,此时测得容器内B为0.8mol,则:
3A(g)+B(g)?4C(g)
起始量(mol):3 1 0
变化量(mol):0.6 0.2 0.8
平衡量(mol):2.4 0.8 0.8
(1)转化率=$\frac{物质的量变化量}{起始物质的量}$×100%;
(2)平衡常数K=$\frac{{c}^{4}(C)}{{c}^{3}(A)×c(B)}$.
解答 解:t℃时,将3 mol A和1 mol B气体通入容积为2L的密闭容器中,2 min时反应到达平衡状态,此时测得容器内B为0.8mol,则:
3A(g)+B(g)?4C(g)
起始量(mol):3 1 0
变化量(mol):0.6 0.2 0.8
平衡量(mol):2.4 0.8 0.8
(1)A转化率=$\frac{0.6mol}{3mol}$×100%=20%,
故答案为:20%;
(2)平衡常数K=$\frac{{c}^{4}(C)}{{c}^{3}(A)×c(B)}$=$\frac{(\frac{0.8}{2})^{4}}{(\frac{2.4}{2})^{3}×\frac{0.8}{2}}$=$\frac{1}{27}$,
答:该温度下平衡常数为$\frac{1}{27}$.
点评 本题考查化学平衡计算,比较基础,注意三段式在化学平衡计算中应用.

练习册系列答案
相关题目
1.向10mL2mol/L的氯化铝溶液中加入0.5mol/L的烧碱溶液,反应得到沉淀1.56g,则加入的烧碱溶液的体积为( )
| A. | 30mL | B. | 60mL | C. | 90mL | D. | 120mL |
2.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 标准状况下,2.24 L Cl2与足量的稀NaOH溶液反应,转移电子总数为0.2NA | |
| B. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 | |
| C. | 欲配制1.00 L 1.00 mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 | |
| D. | 标准状况下,0.1NA的SO3的体积约为2.24 L |
16.下列说法中,错误的是( )
| A. | 天然气的主要成分是CH4 | |
| B. | 酸性:乙酸>碳酸>次氯酸 | |
| C. | 淀粉、纤维素、蚕丝、油脂都是高分子化合物 | |
| D. | 石油的分馏产品如汽油、煤油、柴油等都是混合物 |
20.关于下列说法正确的是( )
| A. | 配合物[Zn(NH3)4]Cl2配位数为6 | |
| B. | 配合物[Zn(NH3)4]Cl2中,配体为NH3和Cl-,[Zn(NH3)4]2+为内界 | |
| C. | 配合物[Zn(NH3)4]Cl2中Zn2+和NH3以离子键结合 | |
| D. | 在NH4+和Fe(CO)5中都存在配位键 |
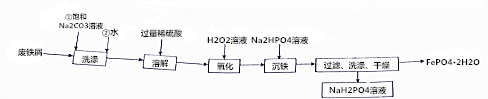
 ;Na2HPO4的电离方程式为Na2HPO4=2Na++HPO42-.
;Na2HPO4的电离方程式为Na2HPO4=2Na++HPO42-.