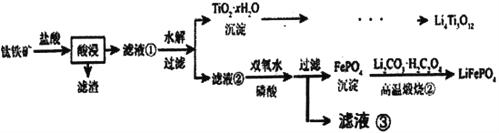
��Ŀ����
����Ŀ��ͭ���ʼ��仯�����ںܶ������ж�����Ҫ����;����ش��������⣺
(1)��ϸͭ�ۿ�����������ϡ������ȣ����Ʊ��������£�

��NH4CuSO3�н��������ӵĺ�������Ų�ʽΪ__________________��N��O��S����Ԫ�صĵ�һ�����ܴ�С˳��Ϊ____________(��Ԫ�ط���)��
����CuSO4��Һ�м��������ˮ��������[Cu(NH3)4]SO4������˵����ȷ����________��
A��������������ˮ��ԭ��֮һ��NH3���Ӻ�H2O����֮���γ������Ե��
B��NH3���Ӻ�H2O���ӣ����ӿռ乹�Ͳ�ͬ���������ӵļ���С��ˮ���ӵļ���
C��[Cu(NH3)4]SO4��Һ�м����Ҵ�������������ɫ�ľ���
D����֪3.4 g��������������ȫȼ����������Ⱦ�����壬���ų�a kJ��������NH3��ȼ���ȵ��Ȼ�ѧ����ʽΪ��NH3(g)��3/4O2(g)===1/2N2(g)��3/2H2O(g)����H����5a kJ��mol��1
(2)ͭ��������(CuMn2O4)���ڳ����´����������е�������Ϊ����(��SO2��Ϊ�ȵ�����)�����ݵȵ���ԭ����O3���ӵĿռ乹��Ϊ________��
(3)���벻ͬ��̬��ͭ���������ֻ�����������Ӿ�Ϊ�������ṹ(��ͼ��ʾ)��aλ����Clԭ��(����һ����λ��)���ӻ��������Ϊ____________________��

(4)��ͼ�ǽ���Ca��D���γɵ�ij�ֺϽ�ľ����ṹʾ��ͼ����֪�����Ͻ�������Ca��D�Ͻ�����ͬ���͵ľ����ṹXYn�������к�ǿ�Ĵ�����������֪�����Ͻ�LaNin�������Ϊ9.0��10��23 cm3��������γ�LaNinH4.5�Ͻ�(����뾧����϶���������)����LaNin��n��______________________(����ֵ)�����ںϽ��е��ܶ�Ϊ________(������λ��Ч����)��

���𰸡�1s22s22p63s23p63d10(��[Ar]3d10) N��O��S AC V�� sp3�ӻ� 5 0.083 g��cm��3
��������
��1����NH4CuSO3�н���������ΪCu+��ͭ��29��Ԫ�أ�ʧȥһ������������ͭ���ӣ�Nԭ��2p���Ϊ������ṹ����һ�����ܴ���Oԭ�ӣ�ͬһ����Ԫ�صĵ�һ����������ԭ���������������С��
A������������ˮ����֮����������
B������������Nԭ�Ӻ�ˮ����Oԭ�Ӿ�Ϊsp3�ӻ�����������Nԭ��ֻ��һ�Թ¶Ե��ӣ�ˮ������Oԭ�������Թ¶Ե��ӣ�
C�������������ܿ�֪���Ҵ����Ӽ�������ˮ�ļ��ԣ�
D��ȼ���ȵ��Ȼ�ѧ����ʽ�У�����H2OΪҺ̬��
��2��O3������SO2��Ϊ�ȵ����壬�ȵ����������ͬ�Ŀռ乹�ͣ�
��3��aλ���ϵ�Cl�γ���2������������2�Թ¶Ե��ӣ�
��4����ͼ��֪���ھ����ϡ����������Ϲ���4��Dԭ�ӣ���ǰ���������ĸ����Ϲ���4��Dԭ�ӣ��ھ��������Ļ���һ��Dԭ�ӡ�
��1����NH4CuSO3�н���������ΪCu+��ͭ��29��Ԫ�أ������������ԭ����̬ԭ�ӵĵ����Ų�ʽΪ1s22s22p63s23p63d104s1��[Ar]3d104s1����ԭ��ʧȥһ������ʱ��������ͭ���ӣ�ʧȥ�ĵ������������ӣ�������ͭ���ӵĻ�̬�ĵ����Ų�ʽΪ��1S22S22P63S23P63d10��[Ar]3d10��Nԭ��2p���Ϊ������ṹ����һ�����ܴ���Oԭ�ӣ�ͬһ����Ԫ�صĵ�һ����������ԭ���������������С���������һ�����ܴ�СΪN��O��S���ʴ�Ϊ��1S22S22P63S23P63d10��[Ar]3d10��N��O��S��
��A������������ˮ����֮��������������Ĵ���ʹ���ʵ��ܽ�������������ȷ��
B������������Nԭ�Ӻ�ˮ����Oԭ�Ӿ�Ϊsp3�ӻ�����������Nԭ��ֻ��һ�Թ¶Ե��ӣ�ˮ������Oԭ�������Թ¶Ե��ӣ����ݼ۲���ӶԻ������ۿ�֪�������ӵļ��Ǵ���ˮ���ӵļ��ǣ��ʴ���
C�������������ܿ�֪���Ҵ����Ӽ�������ˮ�ļ��ԣ�[Cu(NH3)4]SO4���Ҵ����ܽ�Ƚ��ͣ���[Cu(NH3)4]SO4��Һ�м����Ҵ�����������ɫ�ľ��壬����ȷ��
D����ʾȼ���ȵ��Ȼ�ѧ����ʽ�У�����H2OΪҺ̬���ʴ���
��ѡAC���ʴ�Ϊ��AC��
��2��O3������SO2��Ϊ�ȵ����壬SO2������Sԭ�Ӽ۲���Ӷ���Ϊ3���¶Ե�����Ϊ1���ռ乹��ΪV�Σ��ȵ����������ͬ�Ŀռ乹�ͣ���O3���ӿռ乹��ΪV�Σ��ʴ�Ϊ��V�Σ�
��3��aλ���ϵ�Cl�γ���2������������2�Թ¶Ե��ӣ���Ϊsp3�ӻ����ʴ�Ϊ��sp3�ӻ���
��4�������Ͻ�Ca��D�Ͻ�����ͬ���͵ľ����ṹXYn����ͼ��֪���ھ����ϡ����������Ϲ���4��Dԭ�ӣ���ǰ���������ĸ����Ϲ���4��Dԭ�ӣ��ھ��������Ļ���һ��Dԭ�ӣ���Ca��D�ĸ�����Ϊ8��![]() ����8��
����8��![]() +1��=1��5����n=5���������Ϊ9.0��10-23cm3��LaNinH4.5�Ͻ���H������Ϊ
+1��=1��5����n=5���������Ϊ9.0��10-23cm3��LaNinH4.5�Ͻ���H������Ϊ![]() =
=![]() �����ںϽ��е��ܶ�Ϊ
�����ںϽ��е��ܶ�Ϊ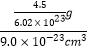 =0.083 g��cm��3���ʴ�Ϊ��0.083 g��cm��3��
=0.083 g��cm��3���ʴ�Ϊ��0.083 g��cm��3��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�