题目内容
【题目】磷酸铁锂电池是新型的绿色能源电池,其简化的生产工艺流程如下。
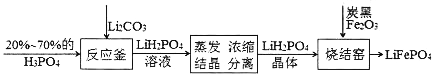
(1)反应釜中反应的化学方程式为_______,该反应体现出非金属性关系:P_____C(填“>”或“<”)。
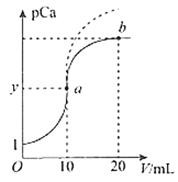
(2)室温下,LiH2PO4溶液的pH随c(H2PO4-)的变化如图1所示,H3PO4溶液中H2PO4-的分布分数![]() 随pH的变化如图2所示[
随pH的变化如图2所示[![]() (含P元素的粒子)]。
(含P元素的粒子)]。
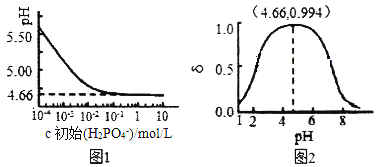
①由图1知,低浓度时LiH2PO4溶液的pH小于7,且随着c初始(H2PO4-)的增大而减小,其合理的解释为__________________。
②综合上图分析,若用浓度大于1mol/L的H3PO4溶液溶解Li2CO3,要使反应釜中的H3PO4几乎全部转化成LiH2PO4,反应釜中需要控制溶液的pH=________。
(3)磷酸铁锂电池总反应为:LiFePO4+6C![]() Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向______(填“阳极”或“阴极”);放电时,正极反应式为__________________。
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向______(填“阳极”或“阴极”);放电时,正极反应式为__________________。
(4)磷酸铁锂电池中铁的含量可通过如下方法测定:称取1.60g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.030mol/L重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液50.00mL。
已知:2Fe3++Sn2++6Cl-=SnCl62-+2Fe2+
4Cl-+Sn2++2HgCl2=SnCl62-+Hg2Cl2
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
①实验中加入HgCl2饱和溶液的目的是____________。
②铁的百分含量Fe(%)=_________________________。
【答案】2H3PO4+Li2CO3=2LiH2PO4+H2O+CO2↑ > H2PO4-在溶液中既存在电离平衡,也存在水解平衡。电离作用产生H+使溶液显酸性,水解产生OH-使溶液显碱性,由于H2PO4-电离程度大于水解程度,所以溶液显酸性,故pH<7;若在开始时溶液c(H2PO4-)大,单位体积内H2PO4-电离产生的H+的数目越多,c(H+)就越大,溶液的pH就越小 4.66 阴极 Li1-xFePO4+xLi++xe-=LiFePO4 将溶液中过量的Sn2+转化为稳定的络离子SnCl62-,防止干扰Fe2+的测定 31.5%
【解析】
(1)由于酸性:H3PO4>H2CO3,所以在反应釜中发生复分解反应:2H3PO4+Li2CO3=2LiH2PO4+H2O+CO2↑;元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,由于酸性:H3PO4>H2CO3,所以元素的非金属性P>C;
(2)①LiH2PO4在溶液中存在电离平衡H2PO4-![]() H++HPO42-,也存在水解平衡H2PO4-+H2O
H++HPO42-,也存在水解平衡H2PO4-+H2O![]() OH-+H3PO4,电离使溶液显酸性,水解使溶液显碱性,由于H2PO4-电离程度大于水解程度,所以溶液显酸性,pH<7;开始时c(H2PO4-)越大,单位体积内电离的H2PO4-的数目越多,则电离产生的H+的浓度越大,所以溶液的pH越小;
OH-+H3PO4,电离使溶液显酸性,水解使溶液显碱性,由于H2PO4-电离程度大于水解程度,所以溶液显酸性,pH<7;开始时c(H2PO4-)越大,单位体积内电离的H2PO4-的数目越多,则电离产生的H+的浓度越大,所以溶液的pH越小;
②浓度大于1mol/L的H3PO4溶液溶解Li2CO3,当pH达到4.66时,根据图2知![]() =0.994,根据图1知c初始(H2PO4-)接近1mol/L,则H3PO4几乎全部转化为LiH2PO4。故要使H3PO4几乎全部转化成LiH2PO4,溶液的pH控制在pH=4.66;
=0.994,根据图1知c初始(H2PO4-)接近1mol/L,则H3PO4几乎全部转化为LiH2PO4。故要使H3PO4几乎全部转化成LiH2PO4,溶液的pH控制在pH=4.66;
(3)充电时,阳离子Li+移向阴极;放电时,正极发生还原反应,正极反应式为Li1-xFePO4+xLi++xe-=LiFePO4;
(4) ①实验中加入HgCl2饱和溶液,可以发生反应:4Cl-+Sn2++2HgCl2=SnCl62-+Hg2Cl2,这样就可以使溶液中过量的Sn2+转化为稳定的络离子SnCl62-,从而防止用重铬酸钾溶液滴定溶液中Fe2+时干扰实验结果的测定,造成实验误差;
②根据6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O可知n(Fe2+)=6n(Cr2O72-)=6×0.030mol/L×0.0500mL=9×10-3mol,m(Fe)=nM=9×10-3mol×56g/mol=0.504g,所以铁的百分含量= ![]() 。
。

【题目】以硅石(主要成分SiO2)为起始原料生产高纯多晶硅的简化工艺流程如下图所示:
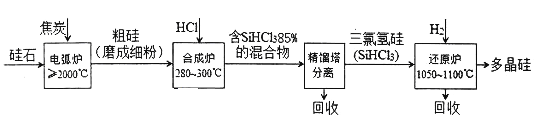
(1)在电弧炉中,生成粗硅的化学方程式为____________,该反应氧化剂与还原剂物质的量之比为_____________。
(2)合成炉中有关反应的数据如下表所示:
热化学方程式 | 平衡常数 | |
主反应 | Si(s)+3HCl(g) | K1 |
副反应 | Si(s)+4HCl(g) | K2 |
①主反应的温度需严格控制在280~300℃之间,若温度过低,则__________________;若温度太高,SiHCl3则会转化生成SiCl4,该转化的热化学方程式为_____________________。
②平衡时,![]() 的值a随着
的值a随着![]() 的值b的变化而变化,则
的值b的变化而变化,则![]() =______(用含K1、K2的代数式表示)。工业上用H2适当稀释HCl来提高
=______(用含K1、K2的代数式表示)。工业上用H2适当稀释HCl来提高![]() 的值,请用平衡移动原理加以解释________________________。
的值,请用平衡移动原理加以解释________________________。
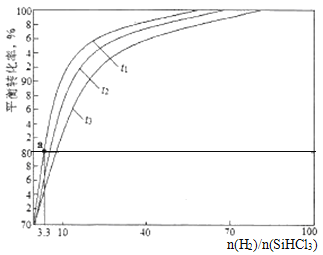
(3)还原炉中的主要反应为SiHCl3(g)+H2(g)=Si(s)+3HCl(g) △H>0。实验室中在1.0L密闭容器中研究得到SiHCl3的转化率在不同温度条件下随n(H2)/(SiHCl3)变化的曲线如图所示。t1、t2、t3表示的温度高低顺序为_______;t1温度时平衡常数Ka=______(保留两位小数)。