题目内容
11.做过银镜反应的试管,应选择下列哪种溶液进行洗涤( )| A. | 盐酸 | B. | 乙醇 | C. | 氢氧化钠 | D. | 硝酸 |
分析 稀HNO3有强氧化性可与银反应,而银和盐酸、氢氧化钠溶液、酒精不反应,由此分析解答.
解答 解:因稀HNO3可与银反应,所以可用稀HNO3清洗做过银镜反应的试管,3Ag+4HNO3=3AgNO3+NO+2H2O,而银和盐酸、氢氧化钠溶液、酒精不反应,故选D.
点评 本题考查硝酸的化学性质,学生要清楚硝酸中+5价的氮的强氧化性,能氧化活泼性弱的金属,难度不大,注意知识的积累.

练习册系列答案
相关题目
1.下列物质中,能使淀粉-碘化钾溶液变蓝的是( )
①氯水 ②碘水 ③KBr ④KI ⑤盐酸.
①氯水 ②碘水 ③KBr ④KI ⑤盐酸.
| A. | ①② | B. | ① | C. | ①③④ | D. | ①⑤ |
19.新型合成弹性材料的结构简式如下: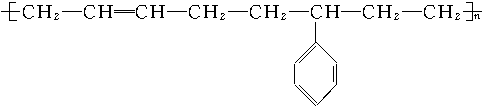 合成此种弹性材料的单体有( )
合成此种弹性材料的单体有( )
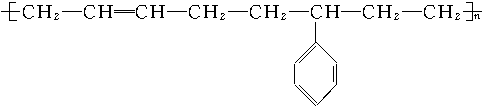 合成此种弹性材料的单体有( )
合成此种弹性材料的单体有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
3.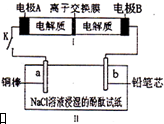 如图所示装置是一种可充电电池,装置II为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )
如图所示装置是一种可充电电池,装置II为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )
 如图所示装置是一种可充电电池,装置II为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )
如图所示装置是一种可充电电池,装置II为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )| A. | 负极反应为2S22--2e-=S42- | |
| B. | 当有0.01 mol Na+通过离子交换膜时,b电极上析出气体112 mL | |
| C. | 闭合K后,b电极附近的pH变小 | |
| D. | 闭合K后,a电极上有气体产生 |
1.下列是A、B、C、D、E五种短周期元素的某些性质:
(1)A原子的核外电子排布的轨道表示式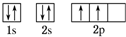 C原子的价电子排布式3s23p5
C原子的价电子排布式3s23p5
(2)A、B、C、G对应的最高价氧化物的水化物酸性最强的是HClO4(写化学式).
(3)相同条件下,AD2与BD2分子在水中的溶解度较大的是SO2(写化学式),理由是CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”,SO2在H2O中的溶解度较大.
(4)A、B、D形成的氢化物沸点:H2O更高,热稳定性H2O更强.(写化学式)
(5)根据等电子原理(化学通式相同且价电子总数相等的分子或离子,结构相似),写出AD分子的结构式C≡O.
(6)已知AG-与G2结构相似,推算HAG分子中σ键与π键数目之比为1:1.
| A | B | C | D | E | G | |
| 最低化合价 | -4 | -2 | -1 | -2 | -1 | -3 |
| 电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 | 3.0 |
 C原子的价电子排布式3s23p5
C原子的价电子排布式3s23p5(2)A、B、C、G对应的最高价氧化物的水化物酸性最强的是HClO4(写化学式).
(3)相同条件下,AD2与BD2分子在水中的溶解度较大的是SO2(写化学式),理由是CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”,SO2在H2O中的溶解度较大.
(4)A、B、D形成的氢化物沸点:H2O更高,热稳定性H2O更强.(写化学式)
(5)根据等电子原理(化学通式相同且价电子总数相等的分子或离子,结构相似),写出AD分子的结构式C≡O.
(6)已知AG-与G2结构相似,推算HAG分子中σ键与π键数目之比为1:1.

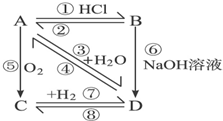 如图所示,各步反应的最后产物D是一种饱和一元醇,其蒸气密度是相同状况下H2密度的23倍,试回答下列问题:
如图所示,各步反应的最后产物D是一种饱和一元醇,其蒸气密度是相同状况下H2密度的23倍,试回答下列问题: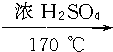 CH2═CH2↑+H2O,⑥CH3CH2Cl+H2O
CH2═CH2↑+H2O,⑥CH3CH2Cl+H2O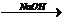 CH3CH2OH+HCl,⑦CH3CHO+H2
CH3CH2OH+HCl,⑦CH3CHO+H2 CH3CH2OH,⑧2CH3CH2OH+O2
CH3CH2OH,⑧2CH3CH2OH+O2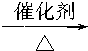 2CH3CHO+2H2O.
2CH3CHO+2H2O.