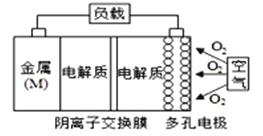
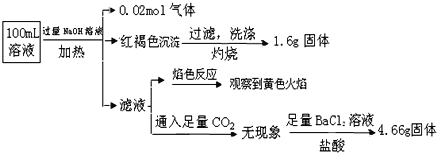
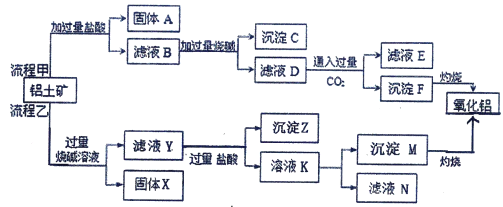
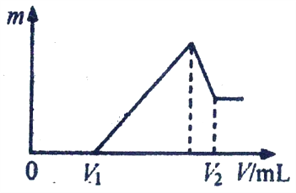
题目内容
【题目】已知X的最低负价与Y的最高正价代数和为零,下列说法正确的是
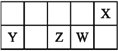
A. 原子半径的大小顺序:r(Y)>r(Z)>r(W)>r(X)
B. Z的最高价氧化物对应水化物的酸性比W的强
C. X的简单气态氢化物的稳定性比W的弱
D. X分别与Y、Z形成的化合物中化学键类型相同
【答案】A
【解析】由短周期主族元素X、Y、Z、W在元素周期表中的相对位置可知X处于第二周期,Y、Z、W处于第三周期,X与Y最外层电子数相差4,设Y的最外层电子数为a,则X最外层电子数为a+4,则Y最高正化合价为+a价,X的最低负化合价为(a+4)-8,又X的最低负价与Y的最高正价代数和为零,故a+(a+4)-8=0,解得a=2,故Y为Mg,则Z为Si、W为P、X为O。A、同周期主族元素从左到右原子半径减小,同主族元素自上而下原子半径增大,故原子半径:r(Y)>r(Z)>r(W)>r(X),A正确;B、非金属性W>Z,故Z的最高价氧化物对应水化物的酸性比W的弱,B错误;C、非金属性X>W,故X的简单气态氢化物的稳定性比W的强,C错误;D、X分别与Y、Z形成的化合物为MgO、SiO2,MgO属于离子化合物,含有离子键,而SiO2属于共价化合物,含有共价键,D错误。答案选A。

【题目】某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体成分。该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现溶液又变澄清,由此该小组成员对气体的成分提出猜想。
【提出猜想】
猜想1:该气体为CO2
猜想2:该气体为SO2
猜想3:_____________________
为了验证猜想,该小组设计实验加以探究:
【实验探究】
该小组同学按如图所示装置,将气体从a端通入,则:
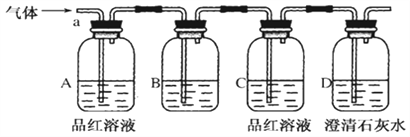
(1)B中应该装下列________试剂(填编号)。
A.NaCl溶液 | B.酸性KMnO4溶液 | C.盐酸 | D.澄清石灰水 |
A中品红溶液的作用是:_________________________________。
C中品红溶液的作用是:_________________________________。
(4)D中澄清石灰水的作用是:_______________________________。
通过该实验,该小组同学观察到以下三个实验现象:
①A中品红溶液褪色 ②C中品红溶液不褪色 ③D中澄清石灰水变浑浊
【得出结论】
(5)由上述现象该小组同学确认该气体的成分为:_______________。