题目内容
【题目】将0.2mol的镁、铝混合物溶于200mL4mol/LHCl溶液中,然后再滴加2mol/LNaOH溶液。
(1) 若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。当V1=160mL时,则金属粉末中n(Mg)=______mol,V2=______mL。

(2) 若在滴加NaOH 溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=______mL。
(3) 若混合物仍为0.2mol。其中Mg粉的物质的量分数为a,用200mL4mol/LHCl溶解此混合物后,再加入450mL2mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是:__________。
【答案】 0.12mol 440mL 400mL 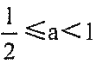
【解析】考查关于铝元素的图像、以及化学计算,(1)根据题意得出n(Al)+n(Mg)=0.2mol,0-V1,发生HCl+NaOH=NaCl+H2O,根据镁、铝与盐酸反应的方程式,有3n(Al)+2n(Mg)=(200×10-3×4-160×10-3×2)mol,解得n(Al)=0.08mol,n(Mg)=0.12mol,当加入NaOH体积为V2时,溶液中的溶质为NaAlO2和NaCl,根据电荷守恒以及元素守恒,有n(Na+)=n(AlO2-)+n(Cl-),n(Na+)=(0.08+200×10-4×4)mol=0.88mol,则V2=0.88×1000/2mL=440mL;(2)Mg2+、Al3+刚好全部转化沉淀,此时的溶液中溶质为NaCl,根据电荷守恒,n(Na+)=n(Cl-)=200×10-4×4mol=0.8mol,此时消耗的氢氧化钠的体积为0.8×1000/2mL=400mL;(3)当沉淀中不含氢氧化铝,沉淀只有氢氧化镁,此时溶液中的溶质为NaCl和NaAlO2,根据电荷守恒,n(Na+)=n(AlO2-)+n(Cl-)=(0.2-0.2a)+200×10-3×4=450×10-3×2,解得a=1/2,当0.2mol全部是镁单质时,沉淀中不含氢氧化铝,因此a的取值范围是 。
。

