题目内容
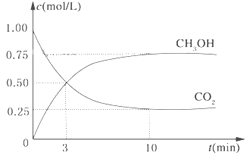
【题目】已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。一定条件下,向体积为1L的密闭容器中充入lmolCO2和3mo1H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。一定条件下,向体积为1L的密闭容器中充入lmolCO2和3mo1H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是

A. 升高温度平衡常数K增大
B. 反应达到平衡状态时,CO2的平衡转化率为75%
C. 3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D. 从反应开始到平衡,H2的平均反应速率v(H2)=0.075 mol·L-1·min-1
【答案】B
【解析】
A、正反应是放热反应,升高温度平衡向逆反应方向进行,平衡常数减小,A错误;
B、根据图像可知平衡时甲醇的浓度是0.75mol/L,消耗CO2是0.75mol/L,CO2的起始浓度是1mol/L,所以CO2的平衡转化率是75%,B正确;
C、3min时反应没有达到平衡状态,则3min时,用CO2的浓度表示的正反应速率不等于用CH3OH的浓度表示的逆反应速率,C错误;
D、平衡时消耗氢气的浓度是3×0.75mol/L,所以从反应开始到平衡,H2的平均反应速率v(H2)=![]() =0.225 mol·L-1·min-1,D错误;
=0.225 mol·L-1·min-1,D错误;
答案选B。

【题目】工业制硝酸的主要反应为4NH3(g)+5O2(g)4NO(g)+6H2O(l)△H
(1)已知:氢气的燃烧热为285.8kJmol-1
N2(g)+3H2(g)2NH3(g)△H=-92.4kJmol-1
N2(g)+O2(g)2NO(g)△H=+180.6kJmol-1
则上述工业制硝酸的主要反应的△H=______。
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
浓度 | c(NH3)(molL-1) | c(O2)(molL-1) | c(NO)(molL-1) |
起始 | 0.8 | 1.6 | 0 |
第2min | 0.6 | a | 0.2 |
第4min | 0.3 | 0.975 | 0.5 |
第6min | 0.3 | 0.975 | 0.5 |
第8min | 0.7 | 1.475 | 0.1 |
①反应在第2min到第4min内,O2的平均反应速率为______。
②反应在第6min时改变了条件,改变的条件可能是______(填序号)。
A 使用催化剂 B 升高温度C 减小压强D 增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g)4NO(g)+6H2O(g)达到平衡状态的是_____(填序号)。
A 单位时间内生成nmolNO的同时,生成nmolNH3
B 条件一定,混合气体的平均相对分子质量不再变化
C 百分含量w(NH3)=w(NO)
D 反应速率v(NH3)∶v(O2) ∶v(NO) ∶v(H2O)=4∶5∶4∶6
E 若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
(3)某研究所组装的CH3OH-O2燃料电池的工作原理如图所示。
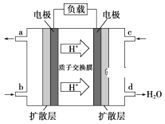
①该电池工作时,b口通入的物质为______。
②该电池正极的电极反应式为______。