题目内容
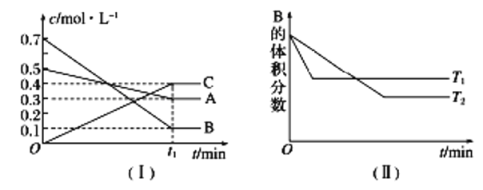
【题目】降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
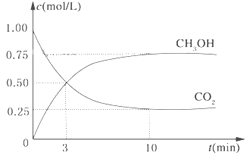
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=______mol/(Lmin);
(2)氢气的转化率=______;
(3)该反应的平衡常数为______(保留小数点后2位);
(4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是______。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol H2
(5)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1______c2的关系(填“>”、“<”或“=”)
【答案】0.225 75% 5.33 CD <
【解析】
(1)根据反应的化学方程式可知
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始浓度(mol/L) 1 3 0 0
转化浓度(mol/L) 0.75 2.25 0.75 0.75
平衡浓度(mol/L) 0.25 0.75 0.75 0.75
从反应开始到平衡,氢气的平均反应速率v(H2)=![]() =0.225molL-1min-1;
=0.225molL-1min-1;
(2)氢气的转化率=![]() ×100%=75%;
×100%=75%;
(3)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则k=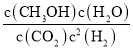 =
=![]() =5.33;
=5.33;
(4)A、要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动。因正反应放热,升高温度平衡向逆反应方向移动,则n(CH3OH)/n(CO2)减小,A错误;
B、充入He(g),使体系压强增大,但物质浓度没有变化,平衡不移动,n(CH3OH)/n(CO2)不变,B错误;
C、将H2O(g)从体系中分离,平衡向正反应方向移动,n(CH3OH)/n(CO2)增大,C正确;
D.再充入1molH2,平衡向正反应方向移动,n(CH3OH)增大,n(CO2)减小,则n(CH3OH)/n(CO2)增大,D正确。
答案选CD。
(5)当反应达到平衡时,向容器中再加入一定量H2,氢气浓度增大,平衡向正反应方向移动,但平衡的移动不能完全抵消氢气浓度的增大,故达到新的平衡状态后,氢气浓度一定比原平衡状态大,即c1<c2。