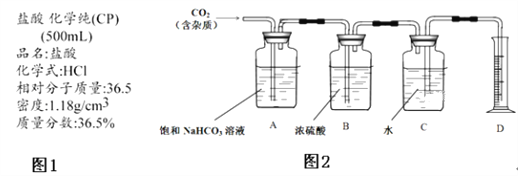
题目内容
【题目】在一个体积为1 L的密闭容器中发生某化学反应:2A(g)![]() B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800° C,实验Ⅲ在950°C。B、C的起始浓度都为0,反应物A的浓度(mol L-1)随时间(min)的变化如图所示。试回答下列问题:
B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800° C,实验Ⅲ在950°C。B、C的起始浓度都为0,反应物A的浓度(mol L-1)随时间(min)的变化如图所示。试回答下列问题:

(1)在实验Ⅰ中,反应在2040 min内A的平均反应速率为________mol L-1min-1。实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是____________。
(2)该反应的ΔH___________0,其判断理由是_____________。
(3)实验Ⅰ第40 min末,若降低反应温度,达到新的平衡后,A的浓度不可能为________(填序号)。
A.0.35 mol·L1 B.0.4 mol·L1 C.0.7 mol·L1 D.0.8 mol·L1
(4)若反应在800°C进行,在该1 L的密闭容器中加入1 mol A、0.2 mol He,达到平衡时A的转化率应____________。
A.等于86% B.等于50% C.小于50% D.在50%86%
【答案】(1)7.5×10-3 实验Ⅱ中使用了催化剂
(2)> 根据实验Ⅲ和实验Ⅰ的比较,可推测该反应升高温度,平衡向正反应方向移动,即正反应为吸热反应
(3)AB (4)B
【解析】(1)在实验Ⅰ中,反应在20~40min内A的平均反应速率为:v(A)=![]() =
=![]() =7.5×10-3 mol·L-1·min-1。实验Ⅱ和实验Ⅰ的平衡状态相同,且在实验Ⅱ中的反应速率更大,说明实验Ⅱ中使用了催化剂。(2)实验Ⅲ和实验Ⅰ相比较,温度升高,A的平衡浓度减小,说明正反应是吸热反应,降低温度,化学平衡向逆反应方向移动。(3)实验Ⅰ在第40 min末,A的平衡浓度为0.5 mol·L-1,降低温度,化学平衡向逆反应方向移动,达到新的平衡时,A的浓度必大于0.5 mol·L-1,不可能是AB。(4)根据800℃时A的起始浓度为1.0 mol·L-1,达到平衡时A的浓度为0.5 mol·L-1,说明A的转化率为50%。若加入1 mol A和0.2 mol He,则使压强增大,因为是恒容条件,稀有气体对平衡无影响,则A的转化率仍为50%。
=7.5×10-3 mol·L-1·min-1。实验Ⅱ和实验Ⅰ的平衡状态相同,且在实验Ⅱ中的反应速率更大,说明实验Ⅱ中使用了催化剂。(2)实验Ⅲ和实验Ⅰ相比较,温度升高,A的平衡浓度减小,说明正反应是吸热反应,降低温度,化学平衡向逆反应方向移动。(3)实验Ⅰ在第40 min末,A的平衡浓度为0.5 mol·L-1,降低温度,化学平衡向逆反应方向移动,达到新的平衡时,A的浓度必大于0.5 mol·L-1,不可能是AB。(4)根据800℃时A的起始浓度为1.0 mol·L-1,达到平衡时A的浓度为0.5 mol·L-1,说明A的转化率为50%。若加入1 mol A和0.2 mol He,则使压强增大,因为是恒容条件,稀有气体对平衡无影响,则A的转化率仍为50%。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案