题目内容
一定条件下,向容积为2L的密闭容器中充入l mol CO2和3 molH2,发生如下反应:
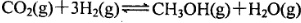 ,5 min后反应达到平衡时c(CH3OH)为0.2 mol
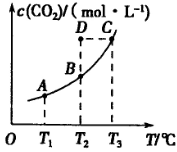
,5 min后反应达到平衡时c(CH3OH)为0.2 mol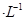 。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是
。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是
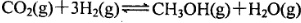 ,5 min后反应达到平衡时c(CH3OH)为0.2 mol
,5 min后反应达到平衡时c(CH3OH)为0.2 mol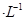 。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是
。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是
A. 0~5 min,CO2的平均反应速率为0.04 mol.(L.min)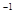 |
B.反应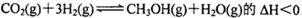 |
C.在T2℃时,若反应处于状态D,则一定有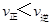 |
| D.若T1℃、T2℃时的平衡常数分别为K1、K2,则K1>K2 |
C
试题分析:A. 5 min后反应达到平衡时c(CH3OH)为0.2 mol/L,则反应消耗的CO2浓度变化Δc(CO2)=" 0.2" mol/L。所以V(CO2)=Δc(CO2)÷Δt="0.2" mol/L÷5 min=0.04mol/(L·min).正确。B.由CO2平衡浓度与温度的关系可知:升高温度CO2浓度增大,说明升高温度排布向逆反应方向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,所以正反应是放热反应。ΔH<0. C.在T2℃时,若反应处于状态D,由于CO2浓度大于该温度的平衡浓度,所以反应向消耗CO2的方向移动。即向正反应方向移动。一定有V正>V逆。错误。D.若T1℃、T2℃时的平衡常数分别为K1、K2,由于该反应的正反应为放热反应,升高温度,平衡逆向移动,T1℃<T2℃则K1>K2。正确。

练习册系列答案
 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
 2NH3(g)(正反应为放热反应),673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。下列叙述中正确的是( )
2NH3(g)(正反应为放热反应),673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。下列叙述中正确的是( ) 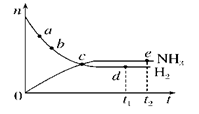
 B+C(g) ΔH=" +Q" kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B+C(g) ΔH=" +Q" kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是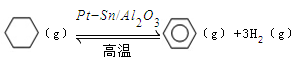 。某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol/L,平衡时苯的浓度为bmol/L,该反应的平衡常数K=_____。
。某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol/L,平衡时苯的浓度为bmol/L,该反应的平衡常数K=_____。
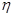 =_____(
=_____( ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位) 设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
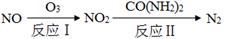
 SO3(g)+NO(g) △H=-41.8 kJ·mol-1
SO3(g)+NO(g) △H=-41.8 kJ·mol-1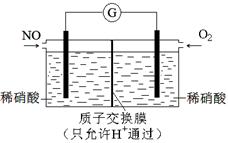
 2D(g) △H=-QKJ·mol-1。相关条件和数据见下表:
2D(g) △H=-QKJ·mol-1。相关条件和数据见下表: CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )