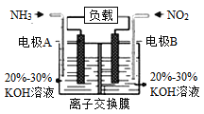
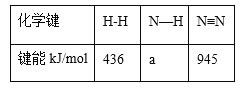
题目内容
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )

A. b 极上的电极反应式为:O2+2H2O+4e-=4OH-
B. 每转移0.1mol电子,消耗1.12L的H2
C. H+由a极通过固体酸电解质传递到b极
D. 电子通过外电路从b极流向a极
【答案】C
【解析】
根据电池总反应:2H2+O2=2H2O可知:通入氢气的一极为电池的负极,发生氧化反应,电极反应式为H2-2e-═2H+,通入氧气的一极为电池的正极,发生还原反应,电极反应式为O2+4e-+4H+=2H2O;电池工作时,电子通过外电路从负极流向正极,即从a极流向b极,电解质溶液中阳离子向正极移动,即H+由a极通过固体酸电解质传递到b极;每转移0.1mol电子,消耗0.05mol的H2,标准状况下的体积为1.12L。
A、该电池为酸性电池,b极电极反应式为O2+4e-+4H+=2H2O,选项A错误;
B、因没有说明是否为标准状况,则消耗氢气的体积不一定为1.12L,选项B错误;
C、原电池中,阳离子向正极移动,所以H+由a极通过固体酸电解质传递到b极,选项C正确;
D、因氢元素的化合价升高,则a为负极,电子应该是通过外电路由a极流向b极,选项D错误;
答案选C。

【题目】某工业废水中仅含表中的离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
阴离子 | Cl- CO32- NO3- SO42- SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
I.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)Ⅲ中加入少量盐酸生成无色气体的离子方程式是____________________。
(2)将Ⅲ中红棕色气体(标况下)收集一满试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为___________mol/L(精确到千分位)。
(3)甲同学最终确定原溶液中所含离子是__________________。
(4)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为_____________g。