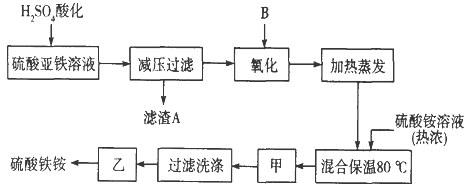
题目内容
【题目】回答下列问题:
(1)下列反应属于放热反应的是_______。
A.铝片与稀H2SO4反应制取H2
B.碳酸钙高温分解成氧化钙和二氧化碳
C.葡萄糖在人体内氧化分解
D.氢氧化钾和硫酸中和
E.Ba(OH)2·8H2O与NH4Cl固体反应
(2)一定条件下,2L密闭容器中SO2与O2反应5min后,若SO2和SO3物质的量分别为0.1 mol和0.3mol,则SO2起始物质的量浓度为_____;用O2表示这段时间该化学反应速率为______。
(3)用活性炭还原法处理氮氧化物。有关反应为C(s)+2NO(g)![]() N2(g)+CO2(g),某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,下列说法不能作为判断该反应达到化学平衡状态标志的是________(填选项字母)
N2(g)+CO2(g),某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,下列说法不能作为判断该反应达到化学平衡状态标志的是________(填选项字母)
A.活性炭的质量保持不变 B.v正(N2)=2v逆(NO)
C.容器内气体压强保持不变 D.容器内混合气体的密度保持不变
E.容器内混合气体的平均相对分子质量保持不变 F.容器内CO2的浓度保持不变
(4)利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能利用化学能,装置如图所示:
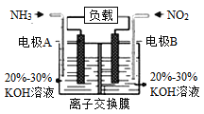
①A电极的电极反应式为_______________。
②下列关于该电池的说法正确的是___________(填选项字母)。
A.电子从右侧电极经过负载后流向左侧电极
B.离子交换膜为阴离子交换膜,则OH-由右侧溶液移向左侧溶液
C. 当有4.48L NO2被处理时,转移电子的物质的量为0.8mol
(5)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。已知: 1molN2和3molH2反应生成2molNH3时放出热量93kJ,试根据表中所列键能数据计算a的数值_________。

【答案】ACD 0.2 mol/L 0.015mol/(L·min) BC 2NH3-6e-+6OH-=N2+6H2O B 391
【解析】
根据放热和吸热反应的定义分析解答;根据化学键的键能与化学反应能量变化的关系分析解答;根据原电池原理分析解答。
(1)A.金属与稀酸反应是放热反应,故A符合题意;
B.碳酸钙高温分解成氧化钙和二氧化碳,是分解反应,该反应为吸热反应,故B不符合题意;
C.葡萄糖在人体内氧化分解,是放热反应,故C符合题意;
D. 氢氧化钾和硫酸中和,酸碱中和反应是放热反应,故D符合题意;
E.Ba(OH)2·8H2O与NH4Cl固体反应是吸热反应,故E不符合题意;
故选ACD。
(2)根据初始时加入的是SO2和O2,反应5min后,SO3物质的量0.3mol,则反应生成了SO30.3mol,2SO2(g)+O2(g)2SO3(g),根据转化量之比=化学计量数之比,则转化的SO2为0.3mol,转化的O2为0.15mol,由反应物初始量=转化量+剩余的量,计算出SO2起始物质的量=0.1mol+0.3mol=0.4mol,初始状态的SO2的物质的量浓度为:c(SO2)=![]() =0.2mol/L,v(O2)=
=0.2mol/L,v(O2)=![]() =
= =0.015mol/(Lmin),
=0.015mol/(Lmin),
故答案为:0.2mol/L;0.015mol/(Lmin);
(3)A.从反应方程式可知,反应前后气体体积不变,反应物的质量不再改变,即正反应速率与逆反应速率相等,说明反应达到化学平衡状态,故A不符合题意;
B.v正(N2)=2v逆(NO)即v正(N2):v逆(NO)=2:1,化学反应速率之比不等于化学计量数之比,故B符合题意;
C.该容器是恒容密闭容器,且反应前后气体体积不变,压强也保持不变,则不能判断反应是否达到平衡状态,故C符合题意;
D.混合气体的密度保持不变,说明气体的质量不变,反应达平衡状态,故D不符合题意;
E.达到平衡时,混合气体的质量不再改变,体积不变,即混合气体的平均相对分子质量保持不变,故E不符合题意;
F.容器内CO2的浓度不变,说明各物质的量不变,正逆反应速率相等,即反应达到平衡状态,故F不符合题意;
故选BC。
(4)①根据方程式可知,NH3失去电子,作还原剂,即A电极为负极,B电极为正极,则A电极的反应方程式为:2NH3-6e-+6OH-=N2+6H2O,故答案为:2NH3-6e-+6OH-=N2+6H2O;
②A.B电极为正极,电子由负极经外电路流向正极,故A错误;
B.原电池中,阴离子向负极移动,故B正确;
C.题干中未指出是否是标准状况下,所以不能计算,故C错误;
故选B。
(5)已知: 1molN2和3molH2反应生成2molNH3时放出热量93kJ,即 1molN≡N断裂吸收945kJ的能量,3molH—H断裂吸收436×3kJ的能量,6molN-H形成,放出6akJ的能量,则可得到等量关系为:6a-945-436×3=93,则a=391kJ;
故答案为:391。

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案【题目】一定条件下,可逆反应2AB+3C,在下列四种状态中,处于平衡状态的是( )
选项 | 正反应速率 | 逆反应速率 |
A | vA=2 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
B | vA=2 mol·L-1·min-1 | vC=2 mol·L-1·min-1 |
C | vA=1 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
D | vA=1 mol·L-1·min-1 | vC=1.5 mol·L-1·min-1 |
A. AB. BC. CD. D