题目内容
17.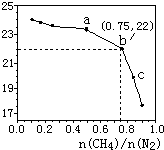 已知:在700℃的恒温、恒容密闭容器中发生反应3CH4(g)+2N2(g)?3C(s)+4NH3(g),若CH4与N2在不同投料比n(CH4)n(N2)时CH4的平衡转化率如图所示,下列说法正确的是( )
已知:在700℃的恒温、恒容密闭容器中发生反应3CH4(g)+2N2(g)?3C(s)+4NH3(g),若CH4与N2在不同投料比n(CH4)n(N2)时CH4的平衡转化率如图所示,下列说法正确的是( )| A. | n(CH4)/n(N2)越大,CH4的转化率越高 | |
| B. | a点对应的平衡常数比c点的大 | |
| C. | b点对应的NH3的体积分数为26% | |
| D. | 不改变投料比,增加n(N2)时,NH3体积分数增大 |
分析 由图可知,纵坐标为甲烷的转化率,横坐标为n(CH4)n(N2),n(CH4)n(N2)越大,甲烷的转化率越小;平衡正向移动时氨气的体积分数增大,且平衡常数只与温度有关,并利用b点甲烷转化率为22%计算氨气的体积分数,以此来解答.
解答 解:A.由图象看出,CH4的转化率随n(CH4)n(N2)的增大而降低,故A错误;
B.ab两点的温度相同,平衡常数只与温度有关,则平衡常数不变,故B错误;
C.b点甲烷转化率为22%,n(CH4)n(N2)=0.75,则设甲烷为3mol,氮气为4mol,
3CH4(g)+2N2(g)?3C(s)+4NH3(g)△H>0
开始 3 4 0
转化 0.66 0.44 0.88
平衡 2.34 3.56 0.88
则NH3的体积分数约为0.882.34+3.56+0.88×100%=13%,故C错误;
D、不改变投料比,增加n(N2)时,必然增加甲烷,平衡正向移动,氨气体积分数增大,故D正确;
故选D.
点评 本题考查化学平衡图象及计算,为高频考点,把握图象中纵横坐标的含义、影响平衡的因素及平衡常数、化学平衡三段法计算等为解答的关键,注重高考高频考点的考查,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.如表实验方案,不能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 检验食盐中是否添加KIO3 | 取食盐试样,溶于KI溶液,加入淀淀溶液,观察溶液是否变蓝 |
| B | 验证硝酸是挥发性酸 | 用两根玻璃棒分别蘸取浓硝酸和浓氨水,然后靠近,观察是否有白烟产生 |
| C | 验证Br2氧化性强于Fe3+ | 取少许FeCl2晶体溶于稀盐酸,加入KSCN观察溶液是否变红,滴入溴水后再观察是否变红 |
| D | 检验氯酸钾中含有氯元素 | 取少量氯酸钾加入MnO2充分加热,残留物溶于水,取上层清液,滴入硝酸酸化的AgNO3溶液,观察是否有白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
5.钠碱循环法是用Na2SO3溶液作为吸收液脱除烟气中的SO2.25℃时,吸收液的pH约为10;吸收过程中,c(SO32-):c(HSO3-)=1:1时,pH为7.2.下列说法正确的是( )
| A. | NaHSO3溶液中:c(SO32-)<c(H2SO3) | |
| B. | 吸收过程中,始终存在着:c(Na+)+c(H+)=c(OH-)+2c(SO32-)+c(HSO3-) | |
| C. | 中性溶液中:c(Na+)>c(HSO3-)=c(SO32-)>c(OH-)=c(H+) | |
| D. | 中性溶液中:c(Na+)=c(SO32-)+c(HSO3-) |
12.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1的Na3PO4溶液中:c(Na+)=3c(PO43-)+2c(HPO42-)+c(H2PO4-) | |
| B. | 0.1mol•L-1的NaHS溶液中:c(H+)+c(H2S)=c(OH-)+c(S2-) | |
| C. | 0.1mol•L-1的氨水与0.1mol•L-1的NaHSO4溶液等体积混合:c(Na+ )=c(SO42-)=c(NH4+)>C(H+)>C(OH-) | |
| D. | 0.1mol•L-1的Na2CO3溶液与0.1mol•L-1的NaHCO3溶液等体积混合:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
8.元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T的一种氧化物能使品红溶渡褪色.则下列判断不正确的是( )
| R | X | |
| T | ||
| Z | Q |
| A. | R的单质结构式为: | |
| B. | 工业上以海水为原料,经氧化还原反应制备Q的单质 | |
| C. | 非金属性:Z<T<X | |
| D. | R原子与Z原子的电子数相差26 |
5.关于化学反应与能量的说法中不正确的是( )
| A. | 中和反应是放热反应 | |
| B. | 右图所示的反应为放热反应 | |
| C. | 化学反应中有物质变化也有能量变化 | |
| D. | 化学键断裂吸收能量,化学键生成放出能量 |
6. C2H5OH、NaClO、H2O2、SO2等常用于杀菌消毒或抑制微生物生长.
C2H5OH、NaClO、H2O2、SO2等常用于杀菌消毒或抑制微生物生长.
(1)写出O2-的结构示意图 .
.
(2)医疗上常用75%的乙醇水溶液作消毒剂,其原理是75%的乙醇水溶液可以使蛋白质变性.
(3)采用无隔膜电解饱和食盐水制NaClO,C12与NaOH溶液充分接触,产物仅为NaClO和H2;NaClO水溶液中存在平衡:ClO-(aq)+H2O?HClO(aq)+OH-(aq) 写出该反应的平衡常数表达式c(HClO)•c(OH−)c(ClO−).
(4)Na2O2、K2O2、BaO2都可与酸作用生成H2O2.实验室可通过上述某种过氧化物与适量稀硫酸作用并过滤,即可制得H2O2溶液,写出该过氧化物与稀硫酸反应的化学方程式BaO2+H2SO4=BaSO4+H2O2.
(5)SO2能被氧气氧化为SO3.查得部分数据如下:
已知,1mol气态SO3转化为液态SO3放出b kJ热量.常温下,SO2被氧气氧化为SO3的热化学反应方程式为2SO2(g)+O2(g)=2SO3(l)△H=-(a+2b)kJ•mol-1.
 C2H5OH、NaClO、H2O2、SO2等常用于杀菌消毒或抑制微生物生长.
C2H5OH、NaClO、H2O2、SO2等常用于杀菌消毒或抑制微生物生长.(1)写出O2-的结构示意图
 .
.(2)医疗上常用75%的乙醇水溶液作消毒剂,其原理是75%的乙醇水溶液可以使蛋白质变性.
(3)采用无隔膜电解饱和食盐水制NaClO,C12与NaOH溶液充分接触,产物仅为NaClO和H2;NaClO水溶液中存在平衡:ClO-(aq)+H2O?HClO(aq)+OH-(aq) 写出该反应的平衡常数表达式c(HClO)•c(OH−)c(ClO−).
(4)Na2O2、K2O2、BaO2都可与酸作用生成H2O2.实验室可通过上述某种过氧化物与适量稀硫酸作用并过滤,即可制得H2O2溶液,写出该过氧化物与稀硫酸反应的化学方程式BaO2+H2SO4=BaSO4+H2O2.
(5)SO2能被氧气氧化为SO3.查得部分数据如下:
| 熔点(℃) | 沸点(℃) | |
| SO2 | -75.5 | -10 |
| SO3 | 16.8 | 44.8 |
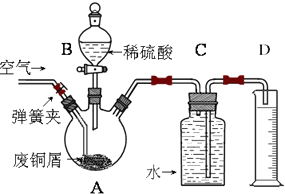 一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液.
一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液.