题目内容
将m mol A 与n mol B 充入一密闭容器中,发生反应如下:m A(g) + n B(g) p C(g);△H = a kJ/mol ( a<0);若在恒温、恒容下达到平衡时A的转化率为A1% ;在绝热、恒容条件下达到平衡时A的转化率为A2%,则A1和A2的关系为
p C(g);△H = a kJ/mol ( a<0);若在恒温、恒容下达到平衡时A的转化率为A1% ;在绝热、恒容条件下达到平衡时A的转化率为A2%,则A1和A2的关系为
 p C(g);△H = a kJ/mol ( a<0);若在恒温、恒容下达到平衡时A的转化率为A1% ;在绝热、恒容条件下达到平衡时A的转化率为A2%,则A1和A2的关系为
p C(g);△H = a kJ/mol ( a<0);若在恒温、恒容下达到平衡时A的转化率为A1% ;在绝热、恒容条件下达到平衡时A的转化率为A2%,则A1和A2的关系为| A.A1<A2 | B.A1=A2 |
| C.A1>A2 | D.不能确定 |
C
正确答案:C
因为反应放热,在绝热、恒容下温度升高,平衡逆向移动,转化率变小,C正确。

练习册系列答案
相关题目

 CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下: 2N2O5(g);
2N2O5(g); ”或“不变”)
”或“不变”) 4NO(g)+6H2O (g)+1025 kJ
4NO(g)+6H2O (g)+1025 kJ 
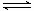 CH3OCH3(g) + H2O(g)的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下: 2SO3(g)。
2SO3(g)。 2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。
2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。 0.5
0.5 2 < Q3 < 197kJ
2 < Q3 < 197kJ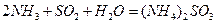

 提高燃煤烟气中
提高燃煤烟气中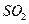 去除率的有 (填字母)。
去除率的有 (填字母)。 2 C(g)
2 C(g) 3HF (正反应为吸热反应)
3HF (正反应为吸热反应)