题目内容
某温度下,反应 2CH3OH(g) 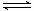 CH3OCH3(g) + H2O(g)的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
下列说法正确的是
A.CH3OH的起始浓度为1.04 mol/L
B.此时逆反应速率大于正反应速率
C.平衡时,CH3OH的浓度为0.04 mol/L
D.平衡时,CH3OH的转化率小于80%
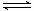 CH3OCH3(g) + H2O(g)的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
A.CH3OH的起始浓度为1.04 mol/L
B.此时逆反应速率大于正反应速率
C.平衡时,CH3OH的浓度为0.04 mol/L
D.平衡时,CH3OH的转化率小于80%
C
由表格中数据可求得甲醇的起始浓度为
反应 2CH3OH(g)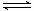 CH3OCH3(g) + H2O(g)
CH3OCH3(g) + H2O(g)
起始浓度: 1.64 0 0
转化浓度: 1.2 0.6 0.6
该时刻浓度:0.44 0.6 0.6
平衡时:
由表格所给数据可求得: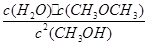 =
=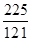 <400,故反应将正向进行,正反应速率大于逆反应速率;
<400,故反应将正向进行,正反应速率大于逆反应速率;
而平衡时各物质浓度:
反应 2CH3OH(g) CH3OCH3(g) + H2O(g)
CH3OCH3(g) + H2O(g)
起始浓度: 1.64 0 0
转化浓度: x x/2 x/2
平衡时: 1.64-x x/2 x/2
代入平衡常数关系式可求得:K=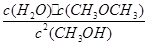 =400,得x为1.6 mol/L,故平衡时CH3OH的浓度为0.04 mol/L,其转化率为
=400,得x为1.6 mol/L,故平衡时CH3OH的浓度为0.04 mol/L,其转化率为 >80%
>80%
故答案为C
反应 2CH3OH(g)
 CH3OCH3(g) + H2O(g)
CH3OCH3(g) + H2O(g)起始浓度: 1.64 0 0
转化浓度: 1.2 0.6 0.6
该时刻浓度:0.44 0.6 0.6
平衡时:
由表格所给数据可求得:
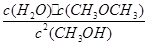 =
=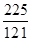 <400,故反应将正向进行,正反应速率大于逆反应速率;
<400,故反应将正向进行,正反应速率大于逆反应速率;而平衡时各物质浓度:
反应 2CH3OH(g)
 CH3OCH3(g) + H2O(g)
CH3OCH3(g) + H2O(g)起始浓度: 1.64 0 0
转化浓度: x x/2 x/2
平衡时: 1.64-x x/2 x/2
代入平衡常数关系式可求得:K=
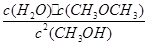 =400,得x为1.6 mol/L,故平衡时CH3OH的浓度为0.04 mol/L,其转化率为
=400,得x为1.6 mol/L,故平衡时CH3OH的浓度为0.04 mol/L,其转化率为 >80%
>80%故答案为C

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 p C(g);△H = a kJ/mol ( a<0);若在恒温、恒容下达到平衡时A的转化率为A1% ;在绝热、恒容条件下达到平衡时A的转化率为A2%,则A1和A2的关系为
p C(g);△H = a kJ/mol ( a<0);若在恒温、恒容下达到平衡时A的转化率为A1% ;在绝热、恒容条件下达到平衡时A的转化率为A2%,则A1和A2的关系为 2SO3 (g);△H=-a kJ·mol-1在相同条件下,要想得到2a kJ热量,加入各物质的物质的量可能是
2SO3 (g);△H=-a kJ·mol-1在相同条件下,要想得到2a kJ热量,加入各物质的物质的量可能是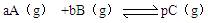 △H=?。反应情况记录如下表:
△H=?。反应情况记录如下表: L-1
L-1 in
in H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1

 氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示: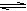 2SO3(g)。下列哪种量不再变化时,不能说明化学反应已经达到平衡状态的是
2SO3(g)。下列哪种量不再变化时,不能说明化学反应已经达到平衡状态的是 xZ(g) ΔH<0。平衡时M中X、Y、Z的物质的量之比为1∶3∶4。下列判断正确的是
xZ(g) ΔH<0。平衡时M中X、Y、Z的物质的量之比为1∶3∶4。下列判断正确的是
 2SO3中,当SO2、O2、SO3三者物质的量之比为2∶1∶2时表示已达平衡状态的标志
2SO3中,当SO2、O2、SO3三者物质的量之比为2∶1∶2时表示已达平衡状态的标志