题目内容
【题目】重铬酸钾(![]() )在制革工业、印刷工业、电镀工业等有重要用途用工业上以铬铁矿
)在制革工业、印刷工业、电镀工业等有重要用途用工业上以铬铁矿![]() ,含
,含![]() 杂质)为原料制备重铬酸钾的工艺如下:
杂质)为原料制备重铬酸钾的工艺如下:
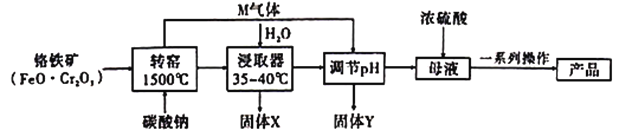
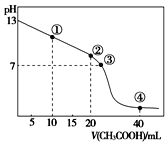
已知:①![]() ;②有关物质的溶解度曲线如图:
;②有关物质的溶解度曲线如图:
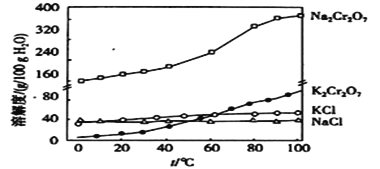
(1)转窑中发生的主要反应除了下面的两个反应外,还有其他反应。
①![]() ;
;
②___![]() ___
___![]() +____
+____![]() ___
___![]() ___
___![]() ___________。
___________。
请配平反应②的化学方程式。
③请写出其他主要反应的化学方程式:_________________________________。
(2)灼烧是中学化学中常用的操作方法,如在实验室中将铬铁矿和碳酸钠固体混合物灼烧,下列各实验仪器中不需要的是___________(填序号)。
A.陶瓷坩埚 B.铁坩埚 C.三脚架 D.泥三角
(3)固体Y成分的化学式为_________________。
(4)向母液中加入浓硫酸,把铬酸钠转化为重铬酸钠,试从平衡的角度说明_______________________________________________________________________。
(5)在“一系列操作”中,其中有一步是加入![]() ,获得该产品的原理是____________________________。
,获得该产品的原理是____________________________。
【答案】4 8 7 8 2 8![]()
![]() A
A ![]() 增大溶液中的氢离子浓度,平衡
增大溶液中的氢离子浓度,平衡![]() 正向移动,使
正向移动,使![]() 转化为
转化为![]() 使
使![]() 转化成溶解度较小的
转化成溶解度较小的![]()
【解析】
根据流程:铬铁矿(FeOCr2O3,含Al2O3、Fe2O3、SiO2杂质)和碳酸钠、氧气混合焙烧,发生反应:4FeOCr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2、Na2CO3+Al2O3
8Na2CrO4+2Fe2O3+8CO2、Na2CO3+Al2O3![]() 2NaAlO2+CO2↑、Na2CO3+SiO2
2NaAlO2+CO2↑、Na2CO3+SiO2![]() Na2SiO3+CO2↑,根据方程式知,生成的气体M是二氧化碳,然后水浸、过滤,固体X为Fe2O3;将滤液通入M气体,溶液中偏铝酸钠和NaOH与二氧化碳溶液生成碳酸钠和氢氧化铝,硅酸钠生成硅酸,然后过滤,固体Y是Al(OH)3、H2SiO3,母液中含有Na2CrO4、Na2CO3和Na2SO4,加入硫酸加入浓硫酸,把铬酸钠转化为重铬酸钠,然后加入KCl将重铬酸钠转化为重铬酸钾,据此分析作答。
Na2SiO3+CO2↑,根据方程式知,生成的气体M是二氧化碳,然后水浸、过滤,固体X为Fe2O3;将滤液通入M气体,溶液中偏铝酸钠和NaOH与二氧化碳溶液生成碳酸钠和氢氧化铝,硅酸钠生成硅酸,然后过滤,固体Y是Al(OH)3、H2SiO3,母液中含有Na2CrO4、Na2CO3和Na2SO4,加入硫酸加入浓硫酸,把铬酸钠转化为重铬酸钠,然后加入KCl将重铬酸钠转化为重铬酸钾,据此分析作答。
(1)根据分析,转窑中铬铁矿和碳酸钠、氧气混合焙烧,发生反应:4FeOCr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2、Na2CO3+Al2O3
8Na2CrO4+2Fe2O3+8CO2、Na2CO3+Al2O3![]() 2NaAlO2+CO2↑、Na2CO3+SiO2
2NaAlO2+CO2↑、Na2CO3+SiO2![]() Na2SiO3+CO2↑;
Na2SiO3+CO2↑;
(2)因为碳酸钠显强碱性,为防止其腐蚀陶瓷坩埚,使用铁坩埚,还需要三脚架、泥三角;故答案为A;
(3)根据分析,浸取后的溶液含有偏铝酸钠、硅酸钠,M为二氧化碳,通入二氧化碳,溶液中偏铝酸钠和NaOH与二氧化碳溶液生成碳酸钠和氢氧化铝,硅酸钠生成硅酸,过滤,固体Y是Al(OH)3、H2SiO3;
(4)母液的成分主要是Na2CrO4,加入浓硫酸,增大溶液中氢离子的浓度,平衡2CrO42-+2H+Cr2O72-+H2O正向移动,使CrO42-转化为Cr2O72-,把铬酸钠转化为重铬酸钠;
(5)根据图可知,K2Cr2O7的溶解度小于Na2Cr2O7

【题目】二甲醚又称甲醚,简称 DME,熔点![]() ,沸点
,沸点![]() ,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。 由合成气(
,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。 由合成气(![]() )制备二甲醚的反应原理如下:
)制备二甲醚的反应原理如下:
①![]()
②![]()
回答下列问题:
(1)已知:![]() ,若由合成气(
,若由合成气(![]() ) 制备
) 制备 ![]() ,且生成
,且生成![]() ,其热化学方程式为_______________。
,其热化学方程式为_______________。
(2)有人模拟该制备原理:500K时,在2L的密闭容器中充入![]() 和
和![]() . 5min达到平衡,平衡时测得
. 5min达到平衡,平衡时测得![]() ,
,![]() ,此时
,此时![]() 的转化率为___________。用
的转化率为___________。用 ![]() 表示反应①的速率是_____________
表示反应①的速率是_____________![]() ,可逆反应②的平衡常数
,可逆反应②的平衡常数 ![]() =_______________________
=_______________________
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数![]() 值变小,则下列说法正确的是_________________ 。
值变小,则下列说法正确的是_________________ 。
A. 平衡向正反应方向移动
B. 平衡移动的原因是升高了温度
C. 达到新平衡后体系的压强不变
D. 容器中![]() 的体积分数减小
的体积分数减小
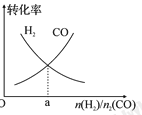
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入![]() 和
和![]() 进行反应①,平衡时
进行反应①,平衡时![]() 和
和![]() 的转化率如图所示,则a=________ (填数值)。
的转化率如图所示,则a=________ (填数值)。
(5)用活性炭还原法处理氮氧化物的有关反应为:![]() 。向恒容密闭容器中加入一定量的活性炭和
。向恒容密闭容器中加入一定量的活性炭和![]() ,恒温(
,恒温(![]() )时,各物质的浓度随时间的变化如下表:
)时,各物质的浓度随时间的变化如下表:
浓度/ 时间/min |
|
|
|
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
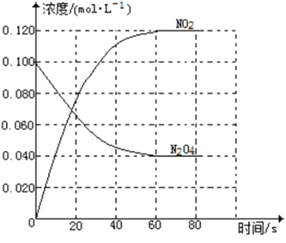
在31 min时,若只改变某一条件使平衡发生移动,40 min,50 min时各物质的浓度如上表所示,则改变的条件是__________________。
在51 min时,保持温度和容器体积不变再充入![]() 和
和![]() ,使二者的浓度均增加至原来的两倍,此时化学平衡__(填“正向移动”、“逆向移动”或“不移动”)。
,使二者的浓度均增加至原来的两倍,此时化学平衡__(填“正向移动”、“逆向移动”或“不移动”)。