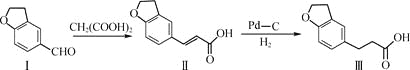
题目内容
【题目】![]() 时,向
时,向![]() 的NaOH溶液中逐滴加入某浓度的
的NaOH溶液中逐滴加入某浓度的![]() 溶液。滴定过程中,溶液的pH与滴入
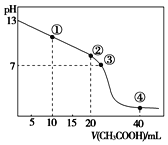
溶液。滴定过程中,溶液的pH与滴入![]() 溶液的体积关系如图所示,点
溶液的体积关系如图所示,点![]() 时NaOH溶液恰好被中和。则下列说法中,正确的是
时NaOH溶液恰好被中和。则下列说法中,正确的是![]()
A.![]() 溶液的
溶液的![]()
B.图中点![]() 到点
到点![]() 所示溶液中,水的电离程度增大
所示溶液中,水的电离程度增大
C.点![]() 所示溶液中存在:
所示溶液中存在:![]()
D.滴定过程中会存在:![]()
【答案】C
【解析】
![]() 根据图象可知,没有加入
根据图象可知,没有加入![]() 溶液时,NaOH溶液的
溶液时,NaOH溶液的![]() ,说明c(NaOH)
,说明c(NaOH)![]() ,
,![]() 点时NaOH溶液恰好被中和消耗醋酸溶液20mL,则醋酸的浓度为
点时NaOH溶液恰好被中和消耗醋酸溶液20mL,则醋酸的浓度为![]() ,由于
,由于![]() 为弱酸,
为弱酸,![]() 的
的![]() 溶液的
溶液的![]() ,故A错误;
,故A错误;
B.图中点![]() 到点
到点![]() 所示溶液中随滴入醋酸反应,水的电离被抑制程度减小,恰好反应时水的电离程度最大,之后继续滴加醋酸,对水电离起到抑制作用,所以图中点
所示溶液中随滴入醋酸反应,水的电离被抑制程度减小,恰好反应时水的电离程度最大,之后继续滴加醋酸,对水电离起到抑制作用,所以图中点![]() 到点
到点![]() 所示溶液中,水的电离程度先增大后减小,故B错误;
所示溶液中,水的电离程度先增大后减小,故B错误;
C.点![]() 所示溶液是等浓度的醋酸和醋酸钠溶液,根据物料守恒可知:
所示溶液是等浓度的醋酸和醋酸钠溶液,根据物料守恒可知:![]() ,溶液中存在电荷守恒:
,溶液中存在电荷守恒:![]() ,二者结合可得:
,二者结合可得:![]() ,故C正确;
,故C正确;
D.溶液中满足电荷守恒,而![]() 违反了电荷守恒,不可能存在该浓度关系,故D错误;
违反了电荷守恒,不可能存在该浓度关系,故D错误;
答案:C。

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目