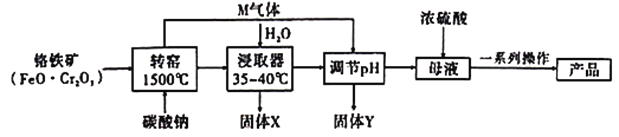
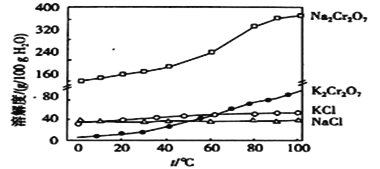
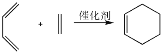题目内容
【题目】25℃时,将 CH3COOH和CH3COONa共0.1配制成1L溶液,溶液中CH3COOH和CH3COO—各自所占的物质的量分数(a)随溶液pH变化的关系如图所示。下列说法不正确的是

A.25℃时, CH3COO—的水解平衡常数为10—9.24
B.pH=4.76时,加入的CH3COOH和CH3COONa物质的量相等
C.pH<4.76时,一定有c(CH3COO—)+c(OH—)>c(H+)
D.4.76<pH<7时,c(CH3COO—)>c( Na+)>c(H+)>c(OH—)
【答案】B
【解析】
A、先求醋酸电离平衡常数,再求出醋酸的电离常数,再结合水的离子积求出水解常数;
B、CH3COOH电离常数大于CH3COO-水解常数;
C、根据电荷守恒:c(CH3COO-)+c(OH-)=c(H+)+c( Na+)判断;
D、根据电荷守恒:c(CH3COO-)+c(OH-)=c(H+)+c( Na+),且c(H+)>c(OH-)判断。
A.PH=4.67时,c(CH3COO-)=c(CH3COOH),醋酸电离平衡常数Ka=![]() =c(H+)=10-4.76,
=c(H+)=10-4.76,
25℃时, CH3COO—的水解平衡常数为=![]() =
=![]() =10—9.24;
=10—9.24;
故A正确;
B. pH=4.76时,c(CH3COO-)=c(CH3COOH),由A选项中电离常数、水解常数大小可知:CH3COOH大于CH3COONa的水解,加入的CH3COOH多于CH3COONa物质的量,故B错误;
C. pH<4.76时,根据电荷守恒:c(CH3COO-)+c(OH-)=c(H+)+c(Na+),一定有c(CH3COO-)+c(OH-)>c(H+),故C正确;
D. 4.76<pH<7时,根据电荷守恒:c(CH3COO-)+c(OH-)=c(H+)+c( Na+),且c(H+)>c(OH-),故c(CH3COO-)>c( Na+),即c(CH3COO-)>c( Na+)>c(H+)>c(OH-),故D正确;
故选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案