题目内容
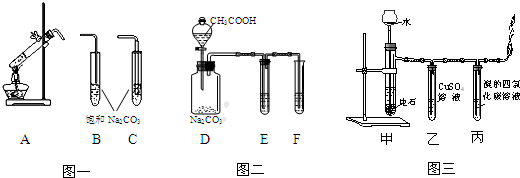
18.如图是实验室制取Cl2,并用Cl2与红热的炭反应的装置.
(1)A中是MnO2和浓盐酸反应生成Cl2的装置.该反应的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)仪器a的名称是长颈漏斗,装置C的名称是洗气瓶.
(3)实验操作:①检查装置气密性.②装入药品后,打开活塞K,点燃A处酒精灯,至装置中充满黄绿色气体(填现象)后,再点燃D处酒精灯.③D处反应完毕后,关闭活塞K,再移去A、D两处酒精灯.由于余热的作用,A处仍然产生少量Cl2,此时观察到B瓶中的现象是长颈漏斗a中液面上升.
(4)D处氯气和炭等反应生成CO2和HCl,写出D处反应的化学方程式2Cl2+C+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4HCl.
(5)C瓶中水的作用提供水蒸气,E处石蕊的现象紫色变红色,E中倒放的漏斗所起的作用防止溶液倒吸.
(6)若将E处溶液改为澄清石灰水,是否有白色沉淀?没有(填“有”或“没有”),其原因是生成的HCl会将沉淀CaCO3溶解.
分析 (1)A装置是制取氯气的发生装置,二氧化锰与浓盐酸在加热条件制备氯气;
(2)由仪器结构可知,a为长颈漏斗;装置C为洗气瓶;
(3)先检查装置气密性,再装入药品,制备氯气,排尽装置内空气后,再点燃D处酒精灯,装置中充满黄绿色气体说明装置内空气排尽,反应完毕后,关闭活塞K,再移去A、D两处酒精灯,由于余热的作用,A处仍然产生少量Cl2,用装置B收集多余的氯气,防止污染环境;
(4)D处氯气和炭、水蒸气反应生成CO2和HCl;
(5)D中需要水参与反应,故C装置提供水蒸气;D中反应生成CO2和HCl,可以式E中紫色石蕊溶液变红色,HCl极易溶于水,E中倒放的漏斗可以防止倒吸;
(6)生成的HCl会将沉淀CaCO3溶解.
解答 解:(1)A装置是制取氯气的发生装置,二氧化锰与浓盐酸在加热条件制备氯气,反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)由仪器结构可知,a为长颈漏斗;装置C为洗气瓶,
故答案为:长颈漏斗;洗气瓶;
(3)先检查装置气密性,再装入药品,制备氯气,排尽装置内空气后,再点燃D处酒精灯,装置中充满黄绿色气体说明装置内空气排尽,反应完毕后,关闭活塞K,再移去A、D两处酒精灯,由于余热的作用,A处仍然产生少量Cl2,用装置B收集多余的氯气,防止污染环境,长颈漏斗a中液面上升,
故答案为:气密性;装置中充满黄绿色气体;长颈漏斗a中液面上升;
(4)D处氯气和炭、水蒸气反应生成CO2和HCl,反应方程式为:2Cl2+C+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4HCl,
故答案为:2Cl2+C+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4HCl;
(5)D中需要水参与反应,故C装置提供水蒸气;D中反应生成CO2和HCl,可以式E中紫色石蕊溶液变红色,HCl极易溶于水,E中倒放的漏斗可以防止倒吸,
故答案为:提供水蒸气;紫色变红色;防止溶液倒吸;
(6)D处于发生反应:2Cl2+C+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4HCl,生成HCl与二氧化碳物质的量之比为4:1,生成的HCl会将沉淀CaCO3溶解,没有沉淀生成,
故答案为:没有;生成的HCl会将沉淀CaCO3溶解.
点评 本题考查氯气的实验室制备、仪器识别、对装置与操作的分析评价等,是对学生综合能力的考查,难度中等.

 一课一练课时达标系列答案
一课一练课时达标系列答案| A. | 金属钾与水反应:2K+2H2O═2K++2OH-+2H2↑ | |
| B. | 氯气通入碘化钾溶液中:Cl2+2I-═2Cl-+I2 | |
| C. | 铜片放入稀硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 醋酸与碳酸钠溶液反应:2CH3COOH+CO32-═2CH3COO-+H2O+CO2↑ |
| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 实验室用大理石与盐酸反应制取二氧化碳:CO32-+2H+═CO2↑+H2O | |
| C. | 实验室用烧碱溶液吸收氯气:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 钠与水的反应:Na+H2O═Na++OH-+H2↑ |
| A. | 量筒 | B. | 碱式滴定管 | C. | 酸式滴定管 | D. | 容量瓶 |
| A. | 1 mol/L | B. | 0.5mol/L | C. | 0.25mol/L | D. | 0.2mol/L |
| A. | 水 | B. | NaOH溶液 | ||
| C. | 酚酞 | D. | 硝酸酸化的硝酸银溶液 |
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
(1)若25<t1<t2,则α>1×10-14(填“>”“<”或“=”),作出此判断的理由是
升高温度,水的电离程度增大,离子积增大.
(2)已知25℃时饱和NaHCO3溶液的PH>7,则此温度下饱和NaHCO3溶液中各离子浓度关系正确的是AC
A.c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
B.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
C.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.c(OH-)=c(HCO3-)+c(H2CO3)+c(H+)
(3)t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-).
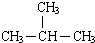 );
);