题目内容
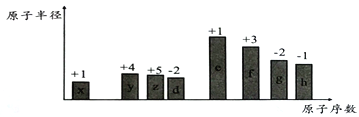
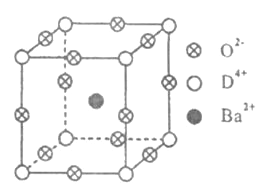
【题目】已知A、B、C、D、E、F都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图1。F元素的正三价离子3d能级为半充满。
(1)A的元素符号是___;E在元素周期表中的位置是__。
(2)B的氢化物的晶体类型是____晶体,B的氢化物与C的氢化物相比,分子极性较大的是__写化学式![]() 。
。
(3)D与B形成的化合物晶体的密度为ag·cm-3,则晶胞的体积是___![]() 只要求列出算式,D和B形成的化合物的M为78g/mol)。
只要求列出算式,D和B形成的化合物的M为78g/mol)。
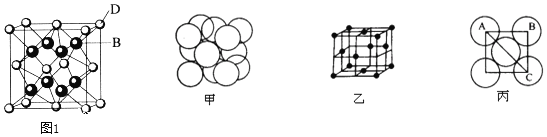
(4)晶胞是晶体中最小的重复单元。已知F元素的单质为面心立方晶体,其结构如图甲所示,面心立方的结构特征如图乙所示。若F原子的半径为1.27×10-10m。试求该金属晶体中的晶胞边长,即图丙中AB的长度为__m。
【答案】H 第四周期第VIIB族 分子 HF ![]() 3.59×10-10
3.59×10-10
【解析】
根据题意,从D、E是周期表中![]() 列中E排第7列可判断E是第4周期VIIB族的Mn元素,原子序数为25,D和E属同一周期,所以D也在第4周期,D的原子序数比E小5,则原子序数为20,应为Ca元素,图中利用均摊法,离子化合物D与B的离子个数比值为
列中E排第7列可判断E是第4周期VIIB族的Mn元素,原子序数为25,D和E属同一周期,所以D也在第4周期,D的原子序数比E小5,则原子序数为20,应为Ca元素,图中利用均摊法,离子化合物D与B的离子个数比值为![]() :2,且D为Ca,则B的化合价为
:2,且D为Ca,则B的化合价为![]() 价,应为第ⅦA族元素,B和C属同一主族,B的序数在前面,B为F,C为Cl;A与其他4种元素既不在同一周期又不在同一主族,所以A为H,据此分析解答。
价,应为第ⅦA族元素,B和C属同一主族,B的序数在前面,B为F,C为Cl;A与其他4种元素既不在同一周期又不在同一主族,所以A为H,据此分析解答。
![]() 综上所述,A的元素符号为H,E是Mn元素;在周期表中第四周期VIIB族;
综上所述,A的元素符号为H,E是Mn元素;在周期表中第四周期VIIB族;
故答案为:H;第四周期第VIIB族;
![]() 为F元素,C为Cl元素,HF熔沸点很低,属于分子晶体;组成分子的元素电负性差别越大,分子的极性越大,F元素是电负性最大的元素,故HF的极性较大;
为F元素,C为Cl元素,HF熔沸点很低,属于分子晶体;组成分子的元素电负性差别越大,分子的极性越大,F元素是电负性最大的元素,故HF的极性较大;
故答案为:分子;HF;
![]() 根据
根据![]() ,根据上述均摊法,每个晶胞中Ca的数目为
,根据上述均摊法,每个晶胞中Ca的数目为![]() ,F原子数目为8个,即4个
,F原子数目为8个,即4个![]() ,所以
,所以![]() ;
;
故答案为:![]() ;
;
![]() 由图丙可知,设边长为a,
由图丙可知,设边长为a,![]() ,即
,即![]() ;
;
故答案为:![]() 。
。