题目内容
【题目】在体积可变的400 ℃密闭容器中,一定量的SO2和O2在催化剂作用下发生反应:2SO2(g)+O2(g) 2SO3(g)+QkJ,下列叙述错误的是( )
2SO3(g)+QkJ,下列叙述错误的是( )
A.增大压强,正反应速率一直增大至不变,平衡正移
B.降低温度,正反应速率比逆反应速率减小的程度小
C.若将三氧化硫分离出,则平衡正向移动,平衡常数K值不变
D.若气体的物质的量减少0.5mol时达到平衡,则该条件下反应放出0.5QkJ的热量
【答案】A
【解析】
A.增大压强,体积减小,浓度增大,正逆反应速率均增大,其中正反应速率先增大后减小至不变,平移正向移动,故A错误;
B.该反应为放热反应,降低温度,平衡逆向移动,则降低温度,正反应速率比逆反应速率减小的程度小,故B正确;
C.平衡常数与温度有关,则若将三氧化硫分离出,则平衡正向移动,而平衡常数K值不变,故C正确;
D.由反应2SO2(g)+O2(g) 2SO3(g)+QkJ可知,气体减少1mol时放热为QkJ,物质的量与热量成正比,则气体的物质的量减少0.5 mol时达到平衡,则该条件下反应放出0.5 Q KJ的热量,故D正确;
2SO3(g)+QkJ可知,气体减少1mol时放热为QkJ,物质的量与热量成正比,则气体的物质的量减少0.5 mol时达到平衡,则该条件下反应放出0.5 Q KJ的热量,故D正确;
故答案为A。

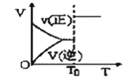
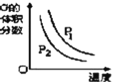
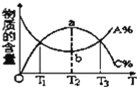
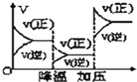
【题目】根据相应的图象(图象编号与答案一一对应),判断下列相关说法正确的是( )
选项 | A | B | C | D |
图像 |
|
|
|
|
反应 | aX(g)+bY(g)cZ(g) | L(s)+aG(g)bR(g) | aA+bBcC | A+2B2C+3D |
操作或条件 | 密闭容器中反应达到平衡,T0时改变某一条件有如图变化所示,则改变的条件一定是加入催化剂 | 反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b | 物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应 | 反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A、B、C是气体,D为固体或液体 |
A.AB.BC.CD.D