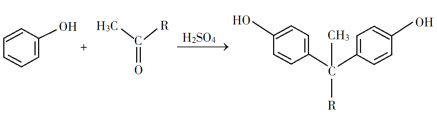
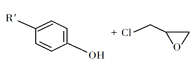
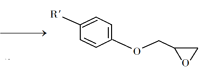
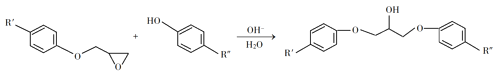
题目内容
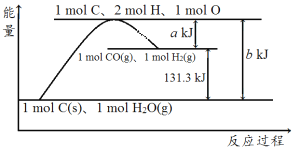
【题目】碳是构成物质世界最重要的元素之一,能形成众多的化合物。
![]() 已知
已知![]() 碳完全燃烧可放出3148kJ热量,
碳完全燃烧可放出3148kJ热量,![]() 液态水汽化时要吸收44kJ热量。
液态水汽化时要吸收44kJ热量。
![]()
![]()
![]()
![]()
请写出制备水煤气的热化学方程式________。
![]() 恒容密闭容器中发生
恒容密闭容器中发生![]() 反应,当通入不同量的
反应,当通入不同量的![]() 和
和![]() 充分反应后得到如下实验数据:
充分反应后得到如下实验数据:
实验组 | 温度
| 起始量
| 平衡量
| 达到平衡所需的时间 | ||
|
|
|
| |||
1 | 650 | 2 |
|
| 2 | 4 |
2 | 650 |
|
|
|
| 5 |
![]() 由实验组1数据可知,达到平衡时
由实验组1数据可知,达到平衡时![]() ________mol/(Lmin)。
________mol/(Lmin)。
![]() 由实验组1和2数据分析可知,增大压强对该可逆反应的影响是________。
由实验组1和2数据分析可知,增大压强对该可逆反应的影响是________。
![]() 若在一定温度、容积可变的密闭容器中发生上述反应,下列说法中可判断该反应达到平衡状态的是________。
若在一定温度、容积可变的密闭容器中发生上述反应,下列说法中可判断该反应达到平衡状态的是________。![]() 填编号
填编号![]()
a.容器中压强不变 b.1molH-H键断裂,同时断裂2molO-H键
c.c(H2O)=c(CO) d.v(H2O)=v(H2) e..容器体积不变
![]() 取
取![]() 草酸亚铁晶体(FeC2O4)样品在惰性气体保护气下加热,测得加热过程中样品质量随温度变化的曲线如图所示:
草酸亚铁晶体(FeC2O4)样品在惰性气体保护气下加热,测得加热过程中样品质量随温度变化的曲线如图所示:
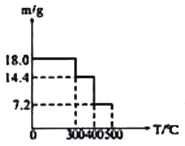
350℃时,固体的成分是________。
②400℃时,样品继续分解得到一种混合气体,该混合气体能使澄清的石灰水变浑浊,也能使灼热的CuO出现红色,则400℃时样品发生反应的化学方程式为________。
③取350℃时的上述样品![]() 难溶于水
难溶于水![]() ,置入0.12mol/L、
,置入0.12mol/L、![]() 的酸性
的酸性![]() 溶液中,二者恰好反应,写出该反应的离子方程式________。
溶液中,二者恰好反应,写出该反应的离子方程式________。
【答案】![]()
![]()
![]() 压强增大,反应速率加快,平衡向逆反应方向移动
压强增大,反应速率加快,平衡向逆反应方向移动 ![]()
![]()
![]()
![]()
![]() 5FeC2O4+24H++3MnO4-=5Fe3++10CO2↑+3Mn2++21H2O
5FeC2O4+24H++3MnO4-=5Fe3++10CO2↑+3Mn2++21H2O
【解析】
![]()
![]()
![]()
![]() ,
,
![]()
![]()
根据![]() 碳完全燃烧可放出
碳完全燃烧可放出![]() 热量可得:
热量可得:
![]()
![]() ,
,
根据盖斯定律由![]() 可得制备水煤气的热化学方程式。
可得制备水煤气的热化学方程式。
![]() 由实验组1数据可知,达到平衡时
由实验组1数据可知,达到平衡时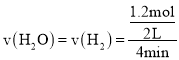 。
。
![]() 实验组1中,H2O的转化率为
实验组1中,H2O的转化率为![]() ,实验组2中,H2O的转化率为
,实验组2中,H2O的转化率为![]() ,由此可知,水蒸气的浓度大,其转化率反而小,从而得出,增大压强对该可逆反应的影响;
,由此可知,水蒸气的浓度大,其转化率反而小,从而得出,增大压强对该可逆反应的影响;
![]() 由于恒温恒压,因此容器中压强始终不变,a不合题意;
由于恒温恒压,因此容器中压强始终不变,a不合题意;
![]() 键断裂,同时断裂
键断裂,同时断裂![]() 键,此时说明正逆反应速率相等,反应达到平衡,b符合题意;
键,此时说明正逆反应速率相等,反应达到平衡,b符合题意;
![]() ,不能说明反应是否平衡,c不合题意;
,不能说明反应是否平衡,c不合题意;
![]() ,没有指明正逆反应速率,不能说明反应是否平衡,d不合题意;
,没有指明正逆反应速率,不能说明反应是否平衡,d不合题意;
![]() 由于保持恒温恒压,且反应后气体分子数增大,所以容器体积不变时反应达到平衡,e符合题意。
由于保持恒温恒压,且反应后气体分子数增大,所以容器体积不变时反应达到平衡,e符合题意。
![]() 草酸亚铁晶体
草酸亚铁晶体![]() 的物质的量为
的物质的量为![]() ,
,![]() 时固体质量为
时固体质量为![]() ,减少的质量为
,减少的质量为![]() ,减少的质量为水的质量,全部失去结晶水,此时所得的产物为无水盐;
,减少的质量为水的质量,全部失去结晶水,此时所得的产物为无水盐;
![]() 时样品继续分解得到一种混合气体,该混合气体能使澄清的石灰水变浑浊,说明有二氧化碳生成;也能使灼热的CuO出现红色,说明有CO生成,剩余固体质量为
时样品继续分解得到一种混合气体,该混合气体能使澄清的石灰水变浑浊,说明有二氧化碳生成;也能使灼热的CuO出现红色,说明有CO生成,剩余固体质量为![]() ,其中铁元素质量为
,其中铁元素质量为![]() ,氧元素的质量为
,氧元素的质量为![]() ,铁元素和氧元素的物质的量之比为
,铁元素和氧元素的物质的量之比为![]() :
:![]() :
:![]() :1,所以剩余固体化学式为FeO;
:1,所以剩余固体化学式为FeO;
![]() 时剩余固体为
时剩余固体为![]() ,其物质的量为
,其物质的量为![]() ,根据高锰酸钾的用量可知反应过程中转移电子的物质的量为
,根据高锰酸钾的用量可知反应过程中转移电子的物质的量为![]() ,当铁元素被氧化为
,当铁元素被氧化为![]() 价,碳元素被氧化为
价,碳元素被氧化为![]() 价时,电子得失守恒,可得出对应反应的离子方程式。
价时,电子得失守恒,可得出对应反应的离子方程式。
![]()
![]()
![]()
![]() ,
,
![]()
![]()
根据![]() 碳完全燃烧可放出
碳完全燃烧可放出![]() 热量可得:
热量可得:
![]()
![]() ,
,
根据盖斯定律由![]() 可得
可得![]()
![]() ;答案为:
;答案为:![]()
![]() ;
;
![]() 由实验组1数据可知,达到平衡时
由实验组1数据可知,达到平衡时 ;答案为:0.15;
;答案为:0.15;
![]() 实验组1中,H2O的转化率为
实验组1中,H2O的转化率为![]() ,实验组2中,H2O的转化率为
,实验组2中,H2O的转化率为![]() ,由此可知,水蒸气的浓度大,其转化率反而小,从而得出增大压强对该可逆反应的影响是压强增大,反应速率加快,平衡向逆反应方向移动;答案为:压强增大,反应速率加快,平衡向逆反应方向移动;
,由此可知,水蒸气的浓度大,其转化率反而小,从而得出增大压强对该可逆反应的影响是压强增大,反应速率加快,平衡向逆反应方向移动;答案为:压强增大,反应速率加快,平衡向逆反应方向移动;
![]() 由于恒温恒压,因此容器中压强始终不变,a不合题意;
由于恒温恒压,因此容器中压强始终不变,a不合题意;
![]() 键断裂,同时断裂
键断裂,同时断裂![]() 键,此时说明正逆反应速率相等,反应达到平衡,b符合题意;
键,此时说明正逆反应速率相等,反应达到平衡,b符合题意;
![]() ,不能说明反应是否平衡,c不合题意;
,不能说明反应是否平衡,c不合题意;
![]() ,没有指明正逆反应速率,不能说明反应是否平衡,d不合题意;
,没有指明正逆反应速率,不能说明反应是否平衡,d不合题意;
![]() 由于保持恒温恒压,且反应后气体分子数增大,所以容器体积不变时反应达到平衡,e符合题意。答案为:be;
由于保持恒温恒压,且反应后气体分子数增大,所以容器体积不变时反应达到平衡,e符合题意。答案为:be;
![]() 草酸亚铁晶体
草酸亚铁晶体![]() 的物质的量为
的物质的量为![]() ,
,![]() 时固体质量为
时固体质量为![]() ,减少的质量为
,减少的质量为![]() ,减少的质量为水的质量,即剩余固体为
,减少的质量为水的质量,即剩余固体为![]() ;答案为:FeC2O4;
;答案为:FeC2O4;
![]() 时样品继续分解得到一种混合气体,该混合气体能使澄清的石灰水变浑浊,说明有二氧化碳生成;也能使灼热的CuO出现红色,说明有CO生成,剩余固体质量为
时样品继续分解得到一种混合气体,该混合气体能使澄清的石灰水变浑浊,说明有二氧化碳生成;也能使灼热的CuO出现红色,说明有CO生成,剩余固体质量为![]() ,其中铁元素质量为
,其中铁元素质量为![]() ,氧元素的质量为
,氧元素的质量为![]() ,铁元素和氧元素的物质的量之比为
,铁元素和氧元素的物质的量之比为![]() :
:![]() :
:![]() :1,所以剩余固体化学式为FeO,对应反应的方程式为:
:1,所以剩余固体化学式为FeO,对应反应的方程式为:![]()
![]()
![]() ;答案为:
;答案为:![]()
![]()
![]() ;
;
![]() 时剩余固体为
时剩余固体为![]() ,其物质的量为
,其物质的量为![]() ,根据高锰酸钾的用量可知反应过程中转移电子的物质的量为
,根据高锰酸钾的用量可知反应过程中转移电子的物质的量为![]() ,当铁元素被氧化为
,当铁元素被氧化为![]() 价,碳元素被氧化为
价,碳元素被氧化为![]() 价时,电子得失守恒,因此对应的离子方程式为
价时,电子得失守恒,因此对应的离子方程式为
5FeC2O4+24H++3MnO4-=5Fe3++10CO2↑+3Mn2++21H2O。答案为:5FeC2O4+24H++3MnO4-=5Fe3++10CO2↑+3Mn2++21H2O。

 阅读快车系列答案
阅读快车系列答案【题目】下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用相应的化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(1)表中用序号标出的10种元素中,化学性质最不活泼的元素的原子结构示意图是___。
(2)③的单质的电子式为___,结构式为___。
(3)④、⑥、⑧的原子半径由小到大的顺序为___(用元素符号作答)。
(4)金属性最强的是___,非金属性最强的是___,②、③、⑨的最高价氧化物的水化物的酸性由弱到强的顺序是___(用化学式作答)。
(5)由表中两种元素的原子按1:1组成的共价化合物M,M为常见液态化合物,其稀液易被催化分解,请写出M的电子式___,M的结构式___。
(6)研究表明:②的最高价氧化物在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为以正四面体向空间伸展,请写出N及其两种同素异形体的名称___、___、___。
(7)写出⑦元素的最高价氧化物对应水化物分别与元素⑥、⑧的最高价氧化物对应水化物的水溶液反应的离子方程式___、___。
(8)⑥与⑦金属性较强的是___(填元素符号),下列表述中能证明这一事实的是___。
a.⑥的单质和⑦的单质熔沸点不同
b.⑥的最高价氧化物水化物的碱性比⑦的最高价氧化物水化物的碱性强
c.⑦最外层的电子数比⑥多
d.⑦的单质与稀盐酸反应比⑥的缓和一些
(9)①和④形成的气态氢化物与①和⑧形成的气态氢化物相比较,___稳定性强;___沸点高(填化学式),理由是___。