题目内容
17. A、B、C、X是中学化学常见物质,它们在一定条件下具有如下转化关系:A+X→B+C+H2O
A、B、C、X是中学化学常见物质,它们在一定条件下具有如下转化关系:A+X→B+C+H2O(1)若X是淀粉水解的最终产物,B为砖红色难溶于水的氧化物.
①X的化学式为C6H12O6.
②A溶于硝酸的离子方程式为Cu(OH)2+2H+=Cu2++2H2O.
③将淀粉水解液中和后,与A的悬浊液(含NaOH)共热至沸腾,产生砖红色沉淀则证明淀粉已经水解.若要进一步探究淀粉是否完全水解,还需用到的试剂是碘水.
(2)若A是由M+和R-构成的盐,X为二元强碱,B为气体.
①B与氧气一定条件下可以发生置换反应,当生成18g液态水时,放出能量Q kJ,该反应的热化学方程式为4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-6QkJ•mol-1;若将该反应设计成燃料电池(以硫酸溶液为电解质溶液),其负极反应式为2NH3-6e-=N2+6H+.
②室温时,20mL 0.10mol•L-1的B溶液用0.050mol•L-1的硫酸溶液滴定,所得滴定曲线如图所示.曲线上a点,c(M+)>c(SO42-)(填“>”、“<”或“=”).曲线上b点,溶液中c(H+)≈7×10-6mol•L-1(只保留一位有效数字).
分析 (1)若X是淀粉水解的最终产物,应为葡萄糖,B为砖红色难溶于水的氧化物,应为Cu2O,则A为Cu(OH)2,C为葡萄糖酸;
(2)若A是由M+和R-构成的盐,X为二元强碱,B为气体,可知A为铵盐,B应为NH3.
①反应的方程式为4NH3(g)+3O2(g)=2N2(g)+6H2O(l),结合生成的水以及放出的热量计算反应热,若将该反应设计成燃料电池,氨气为负极,被氧化生成氮气;
②室温时,20mL 0.10mol•L-1的B溶液用0.050mol•L-1的硫酸溶液滴定,a点时pH=7,结合电荷守恒和水解常数计算.
解答 解:(1)若X是淀粉水解的最终产物,应为葡萄糖,B为砖红色难溶于水的氧化物,应为Cu2O,则A为Cu(OH)2,C为葡萄糖酸,
①葡萄糖的化学式为C6H12O6,故答案为:C6H12O6;
②A为Cu(OH)2,与硝酸反应的离子方程式为Cu(OH)2+2H+=Cu2++2H2O,故答案为:Cu(OH)2+2H+=Cu2++2H2O;
③检验淀粉,可用碘水,因淀粉遇碘变蓝色,故答案为:碘水;
(2)若A是由M+和R-构成的盐,X为二元强碱,B为气体,可知A为铵盐,B应为NH3,
①反应的方程式为4NH3(g)+3O2(g)=2N2(g)+6H2O(l),当生成18g液态水,即1mol时,放出能量Q kJ,
则4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-6Q kJ•mol-1,
若将该反应设计成燃料电池,氨气为负极,被氧化生成氮气,电极方程式为2NH3-6e-=N2+6H+,
故答案为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-6Q kJ•mol-1;2NH3-6e-=N2+6H+;
②室温时,20mL 0.10mol•L-1的B溶液用0.050mol•L-1的硫酸溶液滴定,a点时pH=7,因c(NH4+)+c(H+)=2c(SO42-)+c(OH-),则c(NH4+)=2c(SO42-),
所以c(NH4+)>2c(SO42-),b点时,恰好反应生成硫酸铵,由图象可知0.10mol•L-1的氨水溶液pH=11,则c(OH-)=10-3 mol•L-1,可知一水合氨的电离常数为$\frac{1{0}^{-3}×1{0}^{-3}}{0.1}$=10-5,则铵根离子的水解常数为$\frac{1×1{0}^{-14}}{1{0}^{-5}}$=10-9,所以c2(H+)=(0.05-c(H+))×10-9,c(H+)≈7×10-6 (mol•L-1 ),
故答案为:>;7×10-6 mol•L-1.
点评 本题考查无机物的推断,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握题给信息以及物质的性质,把握弱电解质的电离以及盐类水解的特点,易错点为(2),难度中等.

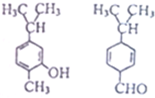
| A. | 互为同分异构体 | B. | 可用银氨溶液区分 | ||
| C. | 均能与溴水反应但反应类型不同 | D. | 分子中共平面的碳原子数一定相同 |
| 盐酸 | 50mL | 50mL | 50mL |
| m(混合物) | 9.2g | 14.2g | 27.6g |
| V(CO2)(标准状况) | 2.24L | 3.36L | 3.36L |
| A. | 盐酸的物质的量浓度为3.0 mol/L | |
| B. | 当混合物质量为9.2 g时,50 mL盐酸恰好完全反应 | |
| C. | 混合物中NaHCO3、KHCO3的物质的量之比为1:2 | |
| D. | 混合物中NaHCO3的质量分数为45.7% |
| A. | (3a+b)mol | B. | (3a+$\frac{b}{2}$)mol | C. | (3a+3p+$\frac{b}{2}$)mol | D. | (3a+$\frac{b}{2}$-3p)mol |
| A. | 在量筒的上端 | B. | 在滴定管上端 | ||
| C. | 在托盘天平分度盘的正中 | D. | 在容量瓶的上端 |


 反应类型为氧化反应.
反应类型为氧化反应. )的核磁共振氢谱有1个信号峰,试写出与其互为同分异构体且核磁共振氢谱有
)的核磁共振氢谱有1个信号峰,试写出与其互为同分异构体且核磁共振氢谱有 )为原料可以合成聚酯PTT,写出其化学方程式
)为原料可以合成聚酯PTT,写出其化学方程式 .
.
 ,请你设计出合理的反应流程图
,请你设计出合理的反应流程图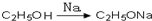 、
、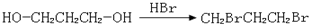 、
、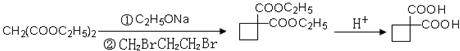 .提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:A$→_{反应条件}^{反应物}$ B$→_{反应条件}^{反应物}$ C …
.提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:A$→_{反应条件}^{反应物}$ B$→_{反应条件}^{反应物}$ C … 物,写出该化学反应方程式CH3CH2OH+CH2=CH2$\stackrel{一定条件下}{→}$CH3CH2OCH2CH3.
物,写出该化学反应方程式CH3CH2OH+CH2=CH2$\stackrel{一定条件下}{→}$CH3CH2OCH2CH3.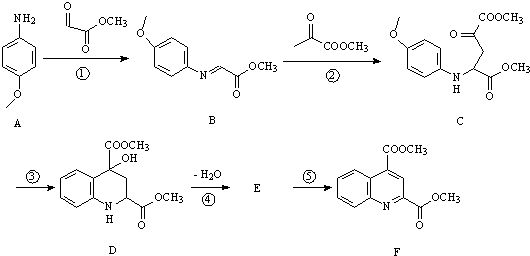

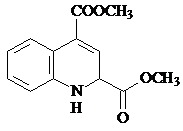 .
. 或
或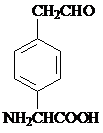 .
.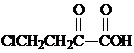 和苯、乙醇为原料,可合成
和苯、乙醇为原料,可合成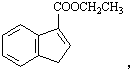 ,写出合成流程
,写出合成流程