题目内容
12.某同学用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(盐酸的物质的量浓度相等).下列分析推理正确的是( )| 盐酸 | 50mL | 50mL | 50mL |
| m(混合物) | 9.2g | 14.2g | 27.6g |
| V(CO2)(标准状况) | 2.24L | 3.36L | 3.36L |
| A. | 盐酸的物质的量浓度为3.0 mol/L | |
| B. | 当混合物质量为9.2 g时,50 mL盐酸恰好完全反应 | |
| C. | 混合物中NaHCO3、KHCO3的物质的量之比为1:2 | |
| D. | 混合物中NaHCO3的质量分数为45.7% |
分析 由题意可知:9.2 g混合物与50 mL盐酸反应时盐酸过量,而27.6 g混合物与50 mL盐酸作用时盐酸不足;
A.求盐酸浓度需选择盐酸不足量的数据进行,盐酸完全反应生成二氧化碳3.36L,结合H++HCO-3=H2O+CO2↑计算n(HCl),再利用c=$\frac{n}{V}$计算;
B.生成3.36L二氧化碳需要混合物的质量为$\frac{3.36L}{22.4L/mol}$×9.2g=13.8g<15.7g,所以9.2 g混合物与50 mL盐酸反应时盐酸过量;
C.第一组实验中混合物完全反应,令NaHCO3、KHCO3的物质的量分别为x、y,根据二者总质量及生成二氧化碳的体积列方程计算解答;
D.根据C中的计算数据可以计算出NaHCO3的质量分数.
解答 解:由题意可知:9.2 g混合物与50 mL盐酸反应时盐酸过量,而27.6 g混合物与50 mL盐酸作用时盐酸不足,
A.由反应H++HCO3-=CO2↑+H2O知,盐酸的物质的量为:n(HCl)=n(CO2)=$\frac{3.36L}{22.4L/mol}$=0.15 mol,所以c(HCl)=0.15 mol÷0.05 L=3 mol/L,故A正确;
B.生成3.36L二氧化碳需要混合物的质量为:$\frac{3.36L}{22.4L/mol}$×9.2g=13.8g<15.7g,所以9.2 g混合物与50 mL盐酸反应时盐酸过量,故B错误;
C.设9.2 g混合物中NaHCO3、KHCO3的物质的量分别为x 和y,则有:
x+y=0.1mol ①
84x+100y=9.2g ②
联立方程,解得:x=0.05 mol,y=0.05 mol
故n(NaHCO3):n (KHCO3)=0.05mol:0.05mol=1:1,故C错误;
D.由C中计算可知,w(NaHCO3)=$\frac{84}{84+100}$×100%=45.7%,故D正确;
故选AD.
点评 本题考查混合物的计算,题目难度较大,通过比较三组数据判断反应的程度为解答该题的关键点,也是易错点,试题侧重考查学生的分析、理解能力及化学计算能力.

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案| A. | 碳、氮原子构成网状的原子晶体 | |
| B. | 膜中的C-N键长比金刚石的C-C键长短 | |
| C. | 碳、氮都是非金属,化合时放出大量热 | |
| D. | 相邻主族非金属的化合物比单质硬度大 |

| A. | X的某种单质是一种新型自来水消毒剂 | |
| B. | 简单离子半径:W->R2->X2->S3+ | |
| C. | R、Z不可能形成离子化合物 | |
| D. | 字母所代表的元素中最高价氧化物的水化物酸性最强的是Y |
| A. | 实验时酸或碱溅到眼中,应立即用水冲洗,并不断眨眼,不能用手搓揉眼睛 | |
| B. | 检验硫酸亚铁铵溶液中Fe2+的方法是:先滴加新制氨水后滴加KSCN溶液 | |
| C. | 证明钢铁吸收氧腐蚀的方法是:在镀锌铁皮上滴1~3滴含酚酞的饱和食盐水,静置1~2min,观察现象 | |
| D. | 用新制氢氧化铜悬浊液不能鉴别乙醇溶液和葡萄糖溶液 |
(1)S位于元素周期表三周期第VIA族,Fe的基态原子核外价电子排布式为3d64s2(或1s22s22p63s23p63d64s2);O的基态原子核外有8种运动状态不同的电子
(2)用“>”“<”或“=”填空
| 第一电离能 | 氧化性 | 沸点 | 非金属性 |
| N>S | Fe3+>Al3+ | NH3<H2O | 16O=18O |
4Fe(s)+302(g)=2Fe2O3(s)△H=-aKJ/mol
4Al(s)+3O2(g)=2Al2O3(S)△H=-bKJ/mol
則Al(s)的单质和Fe2O3(s)反应的热化学方程式是Fe2O3(s)+2Al(s)=Al2O3(s)+2Fe(s)△H=-$\frac{1}{2}$(b-a)KJ•mol-1
(4)FeSO4溶液可与硝酸发生反应,写出此反应的离子方程式,并标出电子转移的方向和数目
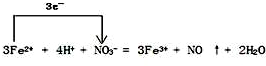 .
. 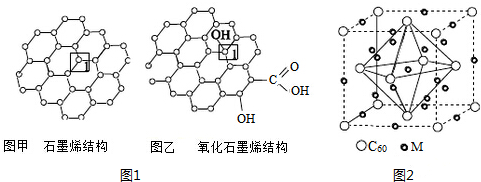
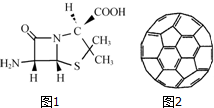 在人类文明的历程中,许多物质发挥过重要作用,如铁、硝酸钾、青霉素、聚乙烯、二氧化硅、富勒烯、含铬物质等.
在人类文明的历程中,许多物质发挥过重要作用,如铁、硝酸钾、青霉素、聚乙烯、二氧化硅、富勒烯、含铬物质等. A、B、C、X是中学化学常见物质,它们在一定条件下具有如下转化关系:A+X→B+C+H2O
A、B、C、X是中学化学常见物质,它们在一定条件下具有如下转化关系:A+X→B+C+H2O