题目内容
【题目】实验室用63%的浓HNO3 (其密度为1.40 g·mL-1)配制200 mL 0.50 mol·L-1稀HNO3。
(1)此浓硝酸的物质的量浓度为________mol·L-1。(计算结果保留两位小数)
(2)应量取63%的浓硝酸____________mL,应选用________( A.10 mL量筒或B.50 mL量筒,填仪器的字母编号)。
(3)实验时还需选用的玻璃仪器有玻璃棒、烧杯、_______________(填仪器的名称)。
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号)________。
①量取浓硝酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③定容时俯视
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
【答案】14.00 7.1 A 胶头滴管、250mL的容量瓶 ①③
【解析】
(1)利用c=![]() 进行计算;
进行计算;
(2)利用稀释定律推导出V浓=![]() ,计算浓硝酸的体积;
,计算浓硝酸的体积;
(3)配制溶液时的过程为:在烧杯中稀释浓硝酸,冷却后沿玻璃棒将溶液转移入容量瓶中,并用蒸馏水洗涤烧杯和玻璃棒2-3次,洗涤液也注入容量瓶,向容量瓶中加水至距刻度线1-2cm处,改用胶头滴管滴加水至凹液面最低点与刻度线相切;
(4)①量取浓硝酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶,取用的浓硝酸过多;
②容量瓶使用时未干燥,对反应结果无影响;
③定容时俯视,使读得的液体体积偏小;
④定容时不小心有少量蒸馏水滴到瓶外,对溶液体积无影响;
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线,加入溶剂过多。
(1)浓HNO3的浓度c=![]() =
=![]() =14.00mol/L,
=14.00mol/L,
(2)V浓=![]() =
=![]() =0.0071L=7.1mL;量取7.1mL的浓硝酸可选择10ml量筒;
=0.0071L=7.1mL;量取7.1mL的浓硝酸可选择10ml量筒;
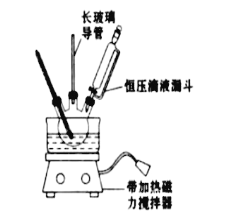
(3)配制溶液时,在烧杯中稀释浓硝酸,冷却后沿玻璃棒将溶液转移入250mL容量瓶中,并用蒸馏水洗涤烧杯和玻璃棒2-3次,洗涤液也注入容量瓶,向容量瓶中加水至距刻度线1-2cm处,改用胶头滴管滴加水至凹液面最低点与刻度线相切,实验时选用的玻璃仪器有玻璃棒、烧杯、胶头滴管和250mL容量瓶;
(4)①量取浓硝酸的量筒用蒸馏水洗涤,并把洗涤液转入容量瓶,取用的浓硝酸过多,导致浓度偏高;
②容量瓶使用时未干燥,对反应结果无影响;
③定容时俯视,使读得的液体体积偏小,导致从都偏高;
④定容时不小心有少量蒸馏水滴到瓶外,溶液体积没有影响,对浓度没有影响;
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线,加入溶剂过多,溶液浓度偏小;
浓度偏高的是①③。