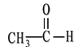题目内容
【题目】某2.0L硫酸溶液中含有1.0molH2SO4。试计算:
(1)溶液中H2SO4的物质的量浓度。___________
(2)向上述溶液中加入足量的铁粉,产生气体的体积(标准状况下)。____________
(3)假设反应前后溶液体积不变,则所得溶液中FeSO4的物质的量浓度。____________
【答案】0.5mol/L 22.4L 0.5mol/L
【解析】
(1)根据c=![]() 计算溶液的浓度;
计算溶液的浓度;
(2)根据反应的方程式列式计算,反应为:Fe+H2SO4=FeSO4+H2↑;
(3)反应后溶液成分为FeSO4,根据H2SO4的物质的量计算。
(1)c(H2SO4)=1.0mol÷2L=0.5mol/L,
答:溶液中H2SO4的物质的量浓度为0.5mol/L;
(2)根据反应的方程式列式计算:
Fe+H2SO4=FeSO4+H2↑
1mol 22.4 L
1.0 mol V(H2)
V(H2)=1.0mol×22.4L÷1mol=22.4L,
答:产生气体的体积为22.4L;
(3)n(FeSO4)=n(H2SO4)=1.0 mol
c(FeSO4)=1.0mol÷2LL=0.5 mol/L
答:所得溶液中FeSO4的物质的量浓度为0.5 mol/L。

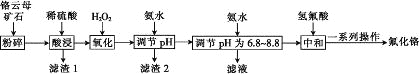
【题目】氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如图。
表中列出了相关金属离子生成氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 | Fe(OH)2 |
开始沉淀的pH | 2.3 | 8.8 | 4.9 | 7.5 |
沉淀完全的pH | 4.1 | 10.4 | 6.8 | 9.7 |
请回答下列问题:
(1)Fe2O3、MgO、FeO、SiO2中属于碱性氧化物的有________种。
(2)将铬云母矿石粉碎的目的是________。
(3)滤渣1主要成分的用途是________。(写一种)
(4)Cr2O3与稀硫酸反应的化学方程式为___________。
(5)第一次滴加氨水调节pH范围为________。
(6)第二次滴加氨水调节pH为6.8~8.8的目的是_______,Cr(OH)3与 Al(OH)3一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:________。
【题目】二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.
工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应:
①CO( g)+2H2(g)![]() CH3OH( g)△H1=-91kJ·mol-1
CH3OH( g)△H1=-91kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H2=-24kJ·mol-1
CH3OCH3(g)+H2O(g)△H2=-24kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g)△H3=-41kJ·mol-1
CO2(g)+H2(g)△H3=-41kJ·mol-1
回答下列问题:
(1)新工艺的总反应为:3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g),该反应△H=______,一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号)。
CH3OCH3(g)+CO2(g),该反应△H=______,一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度d.增加CO的浓度 e.分离出二甲醚
(2)已知反应④2CH3OH(g)![]()
![]() CH3OCH3(g)+H2O(g),某温度下,在1L密闭容器中加入CH3OH,反应10min时达到平衡,此时各组分的浓度如下:
CH3OCH3(g)+H2O(g),某温度下,在1L密闭容器中加入CH3OH,反应10min时达到平衡,此时各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.01 | 0.2 | 0.2 |
①平衡常数表达式K=______,该温度的平衡常数为______。
②若加入CH3OH后,经10 min后达到平衡,该时间内的平均反应速率v(CH3OH)=________。
工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________________________________。