题目内容
2.7.8g Na2R含有0.2mol Na+,则Na2R的摩尔质量为78g/mol;含有1.6gR 的Na2R的物质的量为0.05mol.分析 7.8g Na2R含有0.2mol Na+,则Na2R的物质的量为$\frac{0.2mol}{2}$=0.1mol,故M=$\frac{m}{n}$计算Na2R的摩尔质量,进而计算R的摩尔质量,根据n=$\frac{m}{M}$计算1.6R的物质的量,而n(Na2R)=n(R).
解答 解:7.8g Na2R含有0.2mol Na+,则Na2R的物质的量为$\frac{0.2mol}{2}$=0.1mol,故Na2R的摩尔质量为$\frac{7.8g}{0.1mol}$=78g/mol,故R的摩尔质量为78g/mol-2×23g/mol=32g/mol,1.6R的物质的量为$\frac{1.6g}{32g/mol}$=0.05mol,而n(Na2R)=n(R)=0.05mol,
故答案为:78 g/mol;0.05 mol.
点评 本题考查物质的量计算,比较基础,注意掌握以物质的量为中心的计算,有利于基础知识的巩固.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂.实验室要用黄磷(即白磷)与干燥的 Cl2模拟工业生产制取PCl3,装置如图所示:(部分夹持装置略去)
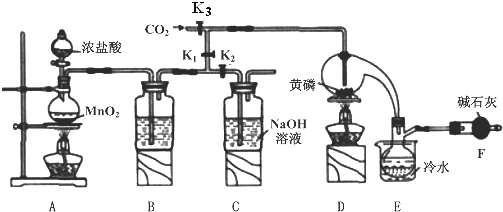
已知:
①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;
②PCl3遇水会强烈水解生成H3PO3和HC1;
③PCl3遇O2会生成POCl3,POCl3溶于PCl3;
④PCl3、POCl3的熔沸点见表:
请回答下列问题:
(1)A装置中制氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B中所装试剂是浓硫酸,F中碱石灰的作用有两种,分别是吸收多余的氯气、防止空气中的H2O进入烧瓶和PCl3 反应.
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃.
(4)粗产品中常含有POCl3、PCl5等,加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O.
(6)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3溶液滴定;
④重复②、③操作平均消耗Na2S2O3溶液8.40mL.
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,假设测定过程中没有其他反应.根据上述数据,该产品中PC13的质量分数为79.75%.

已知:
①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;
②PCl3遇水会强烈水解生成H3PO3和HC1;
③PCl3遇O2会生成POCl3,POCl3溶于PCl3;
④PCl3、POCl3的熔沸点见表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)A装置中制氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B中所装试剂是浓硫酸,F中碱石灰的作用有两种,分别是吸收多余的氯气、防止空气中的H2O进入烧瓶和PCl3 反应.
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃.
(4)粗产品中常含有POCl3、PCl5等,加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O.
(6)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3溶液滴定;
④重复②、③操作平均消耗Na2S2O3溶液8.40mL.
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,假设测定过程中没有其他反应.根据上述数据,该产品中PC13的质量分数为79.75%.
13.铁及其化合物在日常生活、生产中应用广泛.研究铁及其化合物的应用意义重大.
I.水体的净化和污水的处理与铁及其化合物密切相关.
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理FeO42-有强的氧化性,能杀菌消毒,本身被还原为Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,达到净水的目的.
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:
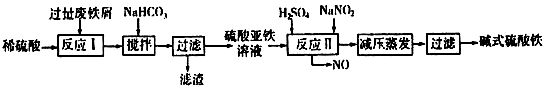
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
回答下列问题:
①写出反应I中发生的氧化还原反应的离子方程式Fe+2H+═Fe2++H2↑.
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为4.4~7.5.
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为69g.
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子.该水解反应的离子方程式为2[Fe(OH)]2++2H2O?[Fe2(OH)4]2++2H+;.
II.铁的化合物也是制备高能锂电池的重要原料.已知磷酸亚铁锂电池总反应为:
FePO4+Li$?_{充电}^{放电}$LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式LiFePO4-e-═FePO4+Li+.常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为14.(忽略溶液的体积变化).
I.水体的净化和污水的处理与铁及其化合物密切相关.
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理FeO42-有强的氧化性,能杀菌消毒,本身被还原为Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,达到净水的目的.
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
①写出反应I中发生的氧化还原反应的离子方程式Fe+2H+═Fe2++H2↑.
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为4.4~7.5.
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为69g.
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子.该水解反应的离子方程式为2[Fe(OH)]2++2H2O?[Fe2(OH)4]2++2H+;.
II.铁的化合物也是制备高能锂电池的重要原料.已知磷酸亚铁锂电池总反应为:
FePO4+Li$?_{充电}^{放电}$LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式LiFePO4-e-═FePO4+Li+.常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为14.(忽略溶液的体积变化).
10.氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁.实验室制备装置和工业制备
流程图如图:
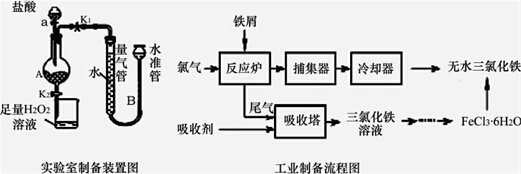
已知:(1)无水FeCl3的熔点为555K、沸点为588K.(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭活塞K2,并打开活塞a,缓慢滴加盐酸.
Ⅱ.当…时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3•6H2O晶体.请回答:
(1)烧杯中足量的H2O2溶液的作用是把亚铁离子全部氧化成三价铁离子.
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是装置A中不产生气泡或量气管和水准管液面不变(其他合理答案也给分).
(3)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入盐酸后、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式:2Fe2++Cl2=2Fe3++2Cl-.
(5)捕集器温度超过673K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为Fe2Cl6.
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol•L-1Na2S2O3溶液滴定,消耗VmL(已知:I2+2S2O32-═2I-+S4O62-).
①滴定终点的现象是:溶液由蓝色变无色,且半分钟内不变色;
②样品中氯化铁的质量分数$\frac{162.5cV}{m}$%.
流程图如图:

已知:(1)无水FeCl3的熔点为555K、沸点为588K.(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
Ⅰ.打开弹簧夹K1,关闭活塞K2,并打开活塞a,缓慢滴加盐酸.
Ⅱ.当…时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3•6H2O晶体.请回答:
(1)烧杯中足量的H2O2溶液的作用是把亚铁离子全部氧化成三价铁离子.
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是装置A中不产生气泡或量气管和水准管液面不变(其他合理答案也给分).
(3)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入盐酸后、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式:2Fe2++Cl2=2Fe3++2Cl-.
(5)捕集器温度超过673K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为Fe2Cl6.
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol•L-1Na2S2O3溶液滴定,消耗VmL(已知:I2+2S2O32-═2I-+S4O62-).
①滴定终点的现象是:溶液由蓝色变无色,且半分钟内不变色;
②样品中氯化铁的质量分数$\frac{162.5cV}{m}$%.
14.某溶液中,若忽略水的电离,只含有下表中所示的四种离子,试推测X离子及其个数b可能为( )
| 离子 | Na+ | Ba2+ | Cl- | X |
| 个数 | 3a | 2a | a | b |
| A. | NO3-、4a | B. | CO32-、3a | C. | OH-、6a | D. | SO42-、3a |
11.下列叙述正确的是( )
| A. | 臭氧空洞、温室效应、光化学烟雾、硝酸型酸雨的形成都与氮氧化合物有关 | |
| B. | 研制出性能优良的催化剂可使反应的温度降低,提高反应速率,从而起到很好的节能效果 | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下△H 不同 | |
| D. | 光分解水制氢气、植物秸秆制沼气、高粱制乙醇都涉及到生物质能的利用 |
12.下列关于铁的描述不正确的是( )
| A. | 在FeSO4溶液中滴入KSCN溶液,溶液显红色 | |
| B. | 铁位于元素周期表中第4周期第Ⅷ族 | |
| C. | 在化合物中,铁通常呈现为+2,+3价 | |
| D. | 通常情况下,铁丝在氯气里燃烧时生成FeCl3 |
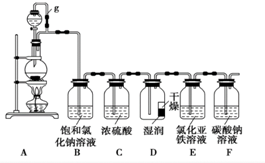 某探究小组为探究氯气的性质,并用装置F制取少量“漂白液”,设计了如下实验装置.请回答下列问题:
某探究小组为探究氯气的性质,并用装置F制取少量“漂白液”,设计了如下实验装置.请回答下列问题: