题目内容
14.某溶液中,若忽略水的电离,只含有下表中所示的四种离子,试推测X离子及其个数b可能为( )| 离子 | Na+ | Ba2+ | Cl- | X |
| 个数 | 3a | 2a | a | b |
| A. | NO3-、4a | B. | CO32-、3a | C. | OH-、6a | D. | SO42-、3a |
分析 由离子共存可知,X不可能为CO32-、SO42-,因为碳酸钡、硫酸钡为沉淀,根据溶液呈电中性原则,溶液中阳离子所带电荷总数等于阴离子所带电荷总数,据此解答.
解答 解:设X的电荷数为n,溶液呈电中性,则溶液中存在3a×N(Na+)+2a×3N(Al3+)=a×N(Cl-)+nb×N(X),
A.3a×N(Na+)+2a×2N(Ba2+)≠a×N(Cl-)+4a×N(NO3-),电荷不守恒,故A错误;
B.Ba2+与CO32-结合为BaCO3沉淀,故B错误;
C.3a×N(Na+)+2a×2N(Ba2+)=a×N(Cl-)+6a×N(OH-),电荷守恒,故C正确;
D.Ba2+与SO42-结合为BaSO4沉淀,故D错误;
故选:C.
点评 本题考查物质的量计算、离子共存等,题目难度不大,注意从溶液电中性的角度分析,学生溶液忽略离子共存问题.

练习册系列答案
相关题目
9.现有①液态氧 ②氢氧化铁胶体 ③食盐水 ④纯碱 ⑤氢氧化钾 ⑥空气 对上述物质的分类全部正确的是( )
| A. | 盐 ③④ | B. | 混合物 ②③⑥ | C. | 纯净物 ④⑤⑥ | D. | 碱 ④⑤ |
6.25℃时,水中存在电离平衡:H2O═H++OH-△H>0.下列叙述正确的是( )
| A. | 将水加热,Kw增大,pH不变 | |
| B. | 向水中加入少量NaHSO4固体,溶液的c(H+)增大,水电离的c(H+)降低 | |
| C. | 向水中加入少量NaOH固体,平衡逆向移动,溶液的c(OH-)降低 | |
| D. | 向水中加入少量NH4Cl固体,平衡正向移动,溶液的c(OH-)增大 |
3.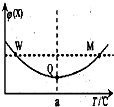 在某恒容密闭容器中充入一定量 X(g)和 Y(g),发生反应2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中 X 的体积分数与温度的 关系如图.下列推断正确的是( )
在某恒容密闭容器中充入一定量 X(g)和 Y(g),发生反应2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中 X 的体积分数与温度的 关系如图.下列推断正确的是( )
 在某恒容密闭容器中充入一定量 X(g)和 Y(g),发生反应2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中 X 的体积分数与温度的 关系如图.下列推断正确的是( )
在某恒容密闭容器中充入一定量 X(g)和 Y(g),发生反应2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中 X 的体积分数与温度的 关系如图.下列推断正确的是( )| A. | M 点时,Y 的转化率最大 | |
| B. | 升高温度,平衡常数减小 | |
| C. | 平衡后充入 Z 达到新平衡时 Z 的体积分数增大 | |
| D. | W,M 两点 Y 的正反应速率相等 |
4.工业上制取镁单质,常将镁蒸气在下列哪种气体环境中冷却( )
①O2
②CO2
③空气
④Ar
⑤N2.
①O2
②CO2
③空气
④Ar
⑤N2.
| A. | ②④⑤ | B. | 只有④ | C. | ③④⑤ | D. | 全部 |
