题目内容
7.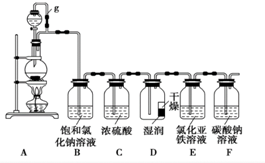 某探究小组为探究氯气的性质,并用装置F制取少量“漂白液”,设计了如下实验装置.请回答下列问题:
某探究小组为探究氯气的性质,并用装置F制取少量“漂白液”,设计了如下实验装置.请回答下列问题:(1)装置A是用来制取氯气的,若烧瓶中盛放的是漂白粉,分液漏斗中是稀硫酸,则①A中反应的化学方程式为:Ca(ClO)2+CaCl2+2H2SO4=2CaSO4↓+2Cl2↑+2H2O.②装置A中g管的作用平衡压强,使稀硫酸能顺利地滴入烧瓶中.
(2)装置D中放有一块红色的纸条,一半用水润湿,一半干燥.实验过程中发现,湿润的部分很快褪色了,又过了一段时间,整块纸条全部褪色.某同学认为是因为装置D中下半部分氯气浓度大于上半部分,这种解释是否合理?不合理(填“合理”或“不合理”),若不合理,请说明真正的原因:实验进行中氯气与湿润纸条中的水生成HClO,使纸条湿润部分褪色,干燥的部分无水,不能生成HClO所以不褪色,但过一段时间后由于水分子运动,整个纸条都变得湿润,所以就全部褪色了(若填“合理”则此空不答).
(3)反应一段时间后用注射器从E中抽取少量溶液,检验出有Fe3+生成,请写出E中发生反应的离子方程式:2Fe2++Cl2=2Fe3++2Cl-.
(4)已知HCO3-的酸性弱于次氯酸,写出少量的氯气与F中足量的碳酸钠溶液反应的总化学方程式:Cl2+2Na2CO3+H2O=NaCl+NaClO+2NaHCO3,反应一段时间后停止反应(此时F中还有碳酸钠剩余),得到355g含氯元素质量分数为10%的“漂白液”,则理论上该“漂白液”中有效成分的物质的量为0.5mol.
分析 装置A为制备氯气的发生装置,制备的氯气中含有氯化氢和水蒸气,通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,通过装置D中放有一块红色的纸条,一半用水润湿,一半干燥,湿润的部分很快褪色了,又过了一段时间,整块纸条全部褪色,说明氯气无漂白性,是氯气和水反应生成的次氯酸具有漂白性,通过装置E中的氯化亚铁溶液,发生反应2Fe2++Cl2=2Fe3++2Cl-,最后通过碳酸钠溶液氯气和水反应生成的盐酸反应生成碳酸氢钠,次氯酸酸性强于碳酸氢根离子,反应生成碳酸氢钠,依次验证氯气的性质,
(1)①分析反应中元素化合价变化,依据氧化还原反应得失电子守恒、原子个数守恒书写方程式;
②导气管将分液漏斗与圆底烧瓶相连,使二者内部压强相等;
(2)根据氯气不能使红色物质褪色,HClO使有色的物质褪色及水分子的运动来分析;
(3)氯气具有强的氧化性能够氧化二价铁离子生成三价铁;
(4)将少量的氯气通入到过量的碳酸钠溶液中,氯气和水反应生成的盐酸反应生成碳酸氢钠,次氯酸酸性强于碳酸氢根离子,反应生成碳酸氢钠;
氯元素含量为10%的漂水溶液355g,则m(Cl)=35.5g,n(Cl)=1mol,再利用n(Cl)=n(NaCl)+n(NaClO)及Cl2+2NaOH═NaCl+NaClO+H2O来分析.
解答 解:(1)①由题意知道:次氯酸钙中氯元素从+1价降为氯气中的0价,1mol次氯酸钙反应得到2mol电子,氯化氢中-1价的氯升高为氯气中0价,1mol氯化氢参加反应失去1mol电子,要使氧化剂与还原剂得失电子守恒,则次氯酸钙系数为1,氯化氢系数为2,依据原子个数守恒,反应方程式:Ca(ClO)2 +4HCl=CaCl2 +2Cl2↑+2H2O;
故答案为:Ca(ClO)2+CaCl2+2H2SO4=2CaSO4↓+2Cl2↑+2H2O;
②导气管将分液漏斗与圆底烧瓶相连,使二者内部压强相等,有利于稀硫酸顺利的滴入烧瓶中,故答案为:平衡压强,使稀硫酸能顺利地滴入烧瓶中;
(2)实验进行中氯气与湿润纸条中的水生成HClO,使纸条湿润部分褪色,干燥的部分无水,不能生成HClO所以不褪色,但过一段时间后由于水分子运动,整个纸条都变得湿润,所以就全部褪色了;
故答案为:不合理;实验进行中Cl2与湿润红色纸条中的水反应生成HClO使湿润的红色纸条褪色,干燥部分没有HClO,所以纸条不褪色,放置一段时间,由于水分子运动会导致整个纸条湿润而褪色;
(3)氯气与二价铁离子反应生成三价铁离子与氯离子,离子方程式:2Fe2++Cl2=2Fe3++2Cl-;
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)将少量的氯气通入到过量的碳酸钠溶液中,氯气和水反应生成的盐酸反应生成碳酸氢钠,次氯酸酸性强于碳酸氢根离子,反应生成碳酸氢钠,化学方程式:Cl2+2Na2CO3+H2O=NaCl+NaClO+2NaHCO3;
氯元素含量为10%的漂水溶液355g,则m(Cl)=×10%=35.5g,n(Cl)=$\frac{35.5g}{35.5g/mol}$=1mol,
由Cl2+2NaOH═NaCl+NaClO+H2O可知,
n(Cl)=n(NaCl)+n(NaClO),则n(NaClO)=$\frac{1mol}{2}$=0.5mol;
故答案为:Cl2+2Na2CO3+H2O=NaCl+NaClO+2NaHCO3;0.5.
点评 本题考查氯气的制取实验装置及氯气的性质,明确装置的作用及装置中发生的化学反应即可解答,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | OH- | B. | -NO2 | C. | -COOH | D. | -Cl |
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钠溶液有白色沉淀产生,再加稀硝酸沉淀不消失,一定有Ag+ | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸沉淀不消失,一定有SO42- |
| A. | 把碳棒放在酒精喷灯上灼烧 2-3min 后即投入到冷水中,重复操作几次,可制得多孔碳棒 | |
| B. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录 溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 | |
| C. | K2CrO4 溶液中存在平衡 2CrO${\;}_{4}^{2-}$+2H+Cr2O${\;}_{7}^{2-}$+H2O,加稀硝酸则溶液由黄色变为橙色 | |
| D. | 分光光度计可以用来测定某些化学反应的反应速率 |
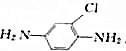 ,B与亚硝酸,在0~5℃反应后生成的产物与溴亚化铜和氰化钾反应生成C,C与氢氧化钠溶液共热生成2-氯-4-硝基苯酚,试推测A、B、C的构造式.
,B与亚硝酸,在0~5℃反应后生成的产物与溴亚化铜和氰化钾反应生成C,C与氢氧化钠溶液共热生成2-氯-4-硝基苯酚,试推测A、B、C的构造式.