题目内容
(1)黄铁矿(FeS2)是制造硫酸的矿物原料,反应历程为FeS2→SO2→SO3→H2SO4,请写出
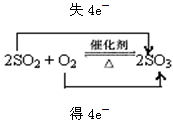
SO2制备SO3反应的化学方程式,并用双线桥标出电子转移的方向和数目 ;
(2)下列酸在与黄铁矿(FeS2)发生反应时,其中S或N元素的化合价不会发生变化的是 ;
a.稀硫酸 b.稀硝酸 c.浓硫酸 d.浓硝酸
(3)从矿物学资料查得,自然界存在反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,
该反应的氧化剂为 ,反应中转移的电子数为 NA;
(4)将(2)中反应的产物溶于水后过滤(Cu2S不溶于水和稀酸),再将滤液滴入用硫酸酸化的高锰酸钾溶液中发现溶液褪色,已知反应后锰元素呈+2价,请写出反应的化学方程式 。
(1) (2)a
(2)a
(3)CuSO4 、FeS2;21(4)10FeSO4+2KMnO4+ 8H2SO4=5Fe2(SO4)3+2MnSO4+K2SO4+8H2O
解析试题分析:(1)SO2在催化剂下转化为SO3即
(2)a、稀硫酸是非氧化性酸,与金属反应时,氢离子显示氧化性,氧化金属,S元素价态不变,故a正确;b、稀硝酸为氧化性酸,与金属反应时,硝酸根显示氧化性,氧化金属,N元素被还原,故b错误;c、浓硫酸是氧化性酸,加热与金属反应时,硫酸根显示氧化性,氧化金属,S元素被还原,故c错误;d、浓硝酸为氧化性酸,与金属反应时,硝酸根显示氧化性,氧化金属,N元素被还原,故d错误;(3)氧化剂发生还原反应化合价降低,14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,Cu元素的化合价由+2价降低为+1价,部分FeS2中的S元素的化合价由-1价降低为-2价,部分FeS2中的S元素的化合价由-1价升高为+6价,故氧化剂为CuSO4 、FeS2;由S元素的化合价升高可知,有3×[6-(-1)]="21" NA e-转移(4)FeS2与稀硫酸反应生成Fe2+将滤液滴入用硫酸酸化的高锰酸钾溶液即发生反应10FeSO4+2KMnO4+ 8H2SO4=5Fe2(SO4)3+2MnSO4+K2SO4+8H2O
考点:硝酸的化学性质;浓硫酸的性质;氧化还原反应

研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)利用反应:6NO2+8NH3 7N2+12H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下的体积是 L。
7N2+12H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下的体积是 L。
(2)①已知:2SO2(g)+O2(g) 2SO3(g) ΔH=?196.6 kJ·mol–1
2SO3(g) ΔH=?196.6 kJ·mol–1
2NO(g)+O2(g) 2NO2(g) ΔH=?113.0 kJ·mol–1
2NO2(g) ΔH=?113.0 kJ·mol–1
请写出NO2与SO2反应生成SO3(g)和NO的热化学方程式 。
②一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO2的同时生成1 molNO2
③测得上述反应平衡时NO2与SO2体积比为1:6,则该反应的平衡常数K= 。
(3)汽车尾气中的一氧化碳可通过如下反应降低其浓度:CO(g)+1/2O2(g) CO2(g)。已知某温度下,在两个恒容密闭容器中进行该反应,容器中各物质的起始浓度及正、逆反应速率关系如下表所示。请用“>”或“<”或“=”填写表中的空格。
CO2(g)。已知某温度下,在两个恒容密闭容器中进行该反应,容器中各物质的起始浓度及正、逆反应速率关系如下表所示。请用“>”或“<”或“=”填写表中的空格。
| 容器编号 | c(CO)/mol·L–1 | c(O2)/mol·L–1 | c(CO2)/mol·L–1 | υ(正)和υ(逆) 大小比较 |
| ① | 2.0×10–4 | 4.0×10–4 | 4.0×10–4 | υ(正)=υ(逆) |
| ② | 1.0×10–3 | 4.0×10–4 | 5.0×10–4 | υ(正) υ(逆) |
现有一未配平的氧化还原反应:
KClO3+PH3+H2SO4→K2SO4+H3PO4+H2O+X
(1)该反应的还原剂是_________。
(2)已知0.2 mol KClO3在反应中得到1 mol电子生成X,则X的化学式是__________。
(3)根据上述反应可推知__________________(填写序号)。
| A.氧化性:KClO3>H3PO4 | B.氧化性:H3PO4>KClO3 |
| C.还原性:PH3>X | D.还原性:X>PH3 |
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
|
 ①洗涤粗品时选用异丙醇而不用水的理由是: 。
①洗涤粗品时选用异丙醇而不用水的理由是: 。②反应I的化学方程式为 。
③反应II的离子方程式为 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整pH= 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是: 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。

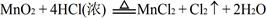 ,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是: 。
,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是: 。