题目内容
H2O2在工业、农业、医药上都有广泛的用途。
(1)H2O2是二元弱酸,写出第一步的电离方程式 ,第二步的电离平衡常数表达式Ka2= 。
(2)许多物质都可以做H2O2分解的催化剂。一种观点认为:在反应过程中催化剂先被H2O2氧化(或还原),后又被H2O2还原(或氧化)。下列物质都可做H2O2分解的催化剂,在反应过程中先被氧化,后被还原的是 。
①I- ②Fe3+ ③Cu2+ ④Fe2+
(3)用碱性氢氧燃料电池合成H2O2,具有效率高,无污染等特点。电池总反应为:
H2 + O2 + OH- = H2O + HO2-。写出正极反应式: 。
(4)H2O2是一种环境友好的强氧化剂。电镀废水(主要含Cu2+、Ni2+,还含少量Fe3+、Fe2+、Cr3+ 等)制备硫酸镍的一种流程如下: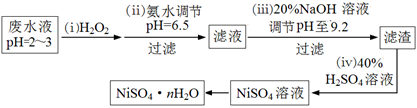
①第(ⅰ)步,加入H2O2反应的离子方程式 。
②第(ⅱ)步,滤渣中的主要成分在医疗上的用途是 。
③为测定NiSO4·n H2O的组成,进行如下实验:称取2.627g样品,配制成250.00 mL溶液。准确量取配制的溶液25.00 mL,用0.04000 mol·L-1的EDTA(Na2H2Y)标准溶液滴定Ni2+(离子方程式为Ni2++ H2Y2-=NiY2-+ 2H+),消耗EDTA标准溶液25.00 mL。则硫酸镍晶体的化学式为 。
(1)H2O2 H+ + HO2-(2分)
H+ + HO2-(2分) 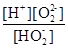 或
或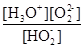 (3分)
(3分)
(2)①④(2分)
(3)O2 + H2O + 2e- = HO2-+ OH- (3分)
(4)①2H++ 2Fe2++ H2O2 = 2Fe3++ 2H2O(3分)
②尿糖的检测(2分)
③NiSO4·6H2O (3分)
解析试题分析:(1)第一步电离,1个H2O2电离出1个H+,电离方程式为:H2O2 H+ + HO2-;第二步电离为:HO2-
H+ + HO2-;第二步电离为:HO2- O22?+H+,所以电离平衡常数Ka2=
O22?+H+,所以电离平衡常数Ka2=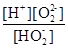 。
。
(2)在反应过程中先被氧化,后被还原,说明该物质具有还原性,I?、Fe2+具有较强的还原性,故①④正确。
(3)正极为O2得电子,根据总反应方程式,O2中O元素化合价降低转化为HO2-,则正极反应方程式为:O2 + H2O + 2e- = HO2-+ OH-
(4)①废水中含有Fe2+,具有还原性,被H2O2氧化,离子方程式为:2H++ 2Fe2++ H2O2 = 2Fe3++ 2H2O
②第(ⅱ)步,滤渣中的主要成分为Cu(OH)2,在医疗上可用于尿糖的检测。
③根据方程式:Ni2++ H2Y2-=NiY2-+ 2H+,原样品含NiSO4的物质的量为:0.04000mol/L×0.025L×250/25=0.01mol,则该物质的摩尔质量为:2.627g÷0.01mol=262.7g/mol,结晶水的系数为:(262.7-154.7)÷18=6,所以化学式为:NiSO4·6H2O
考点:本题考查电离方程式与电极方程式的书写、物质的用途、电离平衡常数、化学式的推断。

 教学练新同步练习系列答案
教学练新同步练习系列答案利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下: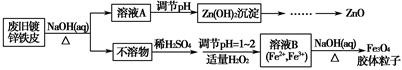
已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用有________。
| A.去除油污 | B.溶解镀锌层 | C.去除铁锈 | D.钝化 |
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是_________________________________________________________。
(4)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取________g K2Cr2O7(保留4位有效数字,已知MK2Cr2O7=294.0 g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有________(用编号表示)。
①电子天平;②烧杯;③量筒;④玻璃棒;⑤容量瓶;⑥胶头滴管;⑦移液管
(5)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将________(填“偏大”“偏小”或“不变”)。
 FeCl3
FeCl3 3Cu2++2R+yH2O。
3Cu2++2R+yH2O。 该反应中,____________元素被还原;该反应中氧化剂和还原剂物质的量之比为__________。
该反应中,____________元素被还原;该反应中氧化剂和还原剂物质的量之比为__________。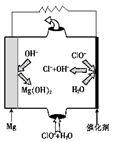
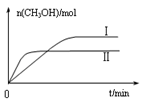
 CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H 
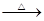 _____Cu+_____CuCl2+N2↑+_____H2O。
_____Cu+_____CuCl2+N2↑+_____H2O。