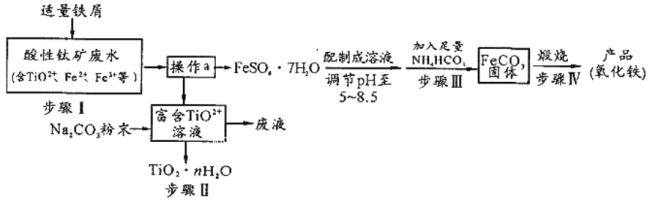
题目内容
【题目】已知:单质A为目前人类使用最广泛的金属,氧化物B为具有磁性的黑色晶体,根据下列转化关系填空。

(1)试判断:A的化学式为_____________,B的名称为_______________。
(2)实验室检验C溶液中的阳离子时,可加入氢氧化钠溶液,若先产生___________色沉淀,该沉淀在空气中迅速变为灰绿色,最终变为_________色,则含该离子。
(3)实验室检验D溶液中的阳离子时,通常可滴加_________,若溶液变为_______色,则含该离子。
(4)若E是一种黄绿色气体单质,该气体是________________,在C→D过程中,此气体做_________剂。
(5)写出固体B与过量盐酸反应的离子方程式__________________________。
(6)写出D + A→C的离子方程式__________________________。
【答案】Fe 四氧化三铁或磁性氧化铁 白 红褐 KSCN 红(血红) Cl2 氧化 Fe3O4+8H+=Fe2++2Fe3++4H2O Fe +2Fe3+=3Fe2+
【解析】
单质A为目前人类使用最广泛的金属,氧化物B为具有磁性的黑色晶体,则A为Fe,B为Fe3O4,加入盐酸,由转化关系可知D为FeCl3,C为FeCl2,E是一种黄绿色气体单质,应为Cl2,据此分析解答。
(1)由以上分析可知A为Fe,B为四氧化三铁,故答案为:Fe;四氧化三铁;
(2)C为FeCl2,亚铁离子与氢氧化钠反应生成氢氧化亚铁,氢氧化亚铁不稳定,易被空气中的氧气氧化,如观察到先产生白色沉淀,在空气中迅速变为灰绿色,最后变为红褐色,则含该离子,故答案为:白;红褐;
(3)D为FeCl3,检验铁离子,可加入KSCN溶液,溶液变红色,故答案为:KSCN溶液;红;
(4)E是一种黄绿色气体单质,应为Cl2,氯气与氯化亚铁反应生成氯化铁,反应中起到氧化剂的作用,故答案为:氯气;氧化;
(5)B为Fe3O4,加入盐酸,反应的离子方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O,故答案为:Fe3O4+8H+=Fe2++2Fe3++4H2O;
(6)D+A→C的离子方程式为Fe+2Fe3+=3Fe2+,故答案为:Fe+2Fe3+=3Fe2+。