题目内容
【题目】如图表示化学反应过程中的能量变化,据图判断下列说法中合理的是( )
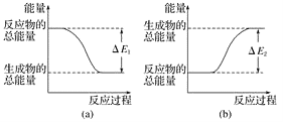
A. 500 mL 2.0 mol·L-1HCl溶液和500 mL 2.0 mol·L-1NaOH溶液的反应符合图(a),且放出热量为ΔE1
B. 500 mL 2.0 mol·L-1H2SO4溶液和500 mL 2.0 mol·L-1Ba(OH)2溶液的反应符合图(b),且吸收热量为ΔE2
C. 发生图(a)能量变化的任何反应,一定不需要加热即可发生
D. CaO、浓硫酸分别溶于水时的能量变化均符合图(a)
【答案】A
【解析】
A.因为HCl和NaOH反应为放热反应,由图可知放出的热量为ΔE1,所以图a符合,故A选项是正确的;
B.硫酸与氢氧化钡反应也是放热反应,而图b为吸热反应,故B错误;
C.加热是反应条件,与反应的热效应无关。有些放热反应也需要加热才能发生,如燃烧反应也需要先加热达到着火点后才能反应,故C错误;
D.浓硫酸溶于水虽然放热,但是物理变化,图a表示的是化学反应过程中的能量变化,故D错误;
所以正确答案为A选项。
.

练习册系列答案
相关题目