题目内容
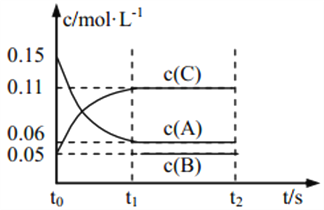
【题目】现将0.4 mol A气体和0.2 mol B气体充入10 L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量的变化如图:

(1)若t1=10 min,则0至t1时间内C物质的平均反应速率为________;该反应在t1时达到平衡,其化学方程式为____________________________________。
(2)据图中曲线变化情况分析,t1时刻改变的反应条件可能是________。
A.加入了催化剂 B.降低了反应温度
C.向容器中充入了C D.缩小了容器体积
【答案】0.001 mol/(L·min)3A(g)+B(g) ![]() 2C(g)AD
2C(g)AD
【解析】
(1)根据v=c/t计算反应速率,根据反应中各物质的变化的物质的量之比等于计量数之比,可写出化学方程式;
(2)根据影响化学反应速率和化学平衡的条件可作判断。
(1)若t1=10 min,则0至t1时间内C物质的平均反应速率为0.1/(10×10)= 0.001 mol/(L·min);根据图可以知道,A、B的物质的量在减小,为反应物,C的物质的量增加,为生成物,且有n(A)=0.40-0.10=0.30mol,n(B)=0.20-0.10=0.10mol;n(C)=0.20-0=0.20mol;再根据反应中各物质的变化的物质的量之比等于计量数之比,该化学方程式为:3A(g)+B(g) ![]() 2C(g) ;综上所述,本题答案是:0.001 mol/(L·min) ,3A(g)+B(g)
2C(g) ;综上所述,本题答案是:0.001 mol/(L·min) ,3A(g)+B(g) ![]() 2C(g)。
2C(g)。
(2) 根据图像,t1时刻不一定是平衡状态,t1-t2不一定是平衡移动,但速率加快;加入了催化剂,加快反应速率,故A正确;降低了反应温度,反应速率减慢,故B错误;向容器中充入了C,C的物质的量应该突变,而图像中C的物质的量是渐变,故C错误;缩小了容器体积,加快反应速率,故D正确;因此,本题正确答案是:AD。