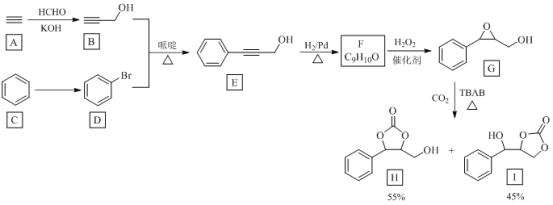
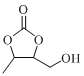
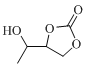
题目内容
【题目】某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种。将13.8 g样品加入足量水,样品全部溶解,再加入过量的CaCl2溶液,得到9 g沉淀。下列关于样品所含杂质的判断正确的是
A.肯定没有KNO3
B.肯定有KNO3,可能还有Na2CO3
C.肯定没有Ba(NO3)2,可能有KNO3
D.肯定没有Na2CO3和 Ba(NO3)2
【答案】B
【解析】
因样品全部溶解,所以样品中一定没有Ba(NO3)2杂质;加入过量的CaCl2溶液,得到9g沉淀为碳酸钙沉淀,则溶液中含有n(CO32—)= ![]() =0.09mol,若全部为碳酸钾中碳酸根离子,则m(K2CO3)=0.09mol×138g/mol=13.42g<13.8 g,由此可知一定含有KNO3;若碳酸根有部分来自于碳酸钠,因碳酸钠的小于138g/mol,则碳酸盐的质量一定小于13.42g<13.8 g,由此可知一定含有KNO3,则K2CO3样品中肯定有KNO3,可能还有Na2CO3,故选B。
=0.09mol,若全部为碳酸钾中碳酸根离子,则m(K2CO3)=0.09mol×138g/mol=13.42g<13.8 g,由此可知一定含有KNO3;若碳酸根有部分来自于碳酸钠,因碳酸钠的小于138g/mol,则碳酸盐的质量一定小于13.42g<13.8 g,由此可知一定含有KNO3,则K2CO3样品中肯定有KNO3,可能还有Na2CO3,故选B。

【题目】中国传统文化对人类文明贡献巨大,古代文献中记载了古代化学研究成果。下列常见古诗文对应的化学知识正确的是
常见古诗文记载 | 化学知识 | |
A | 《梦溪笔谈》中对宝剑的记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折” | 铁的合金硬度比纯铁的大,熔点比纯铁的高 |
B | 《本草纲目拾遗》中对强水的记载:“性最烈,能蚀五金,其水甚强,惟玻璃可盛” | 强水为氢氟酸 |
C | 《天工开物》中记载:凡火药,硫为纯阳,硝为纯阴 | 硫指的是硫黄.硝指的是硝酸钾 |
D | 《泉州府志》中记载:安南人黄姓者为宅煮糖,墙塌压糖,去土而糖白,后人遂效之 | 糖白的过程发生了化学变化 |
A. AB. BC. CD. D
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N | C—H |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 | 414 |
则该反应的ΔH=_________kJ·mol-1。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) CH3OH(g) ΔH <0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
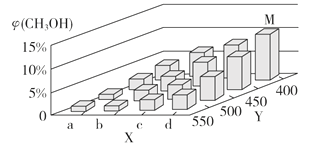
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为_________。
②X轴上a点的数值比b点_________ (填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是________________________________。
(3)工业上可采用CH3OH CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通
CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通
过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为_________(填A、B)。
下图为计算机模拟的各步反应的能量变化示意图。
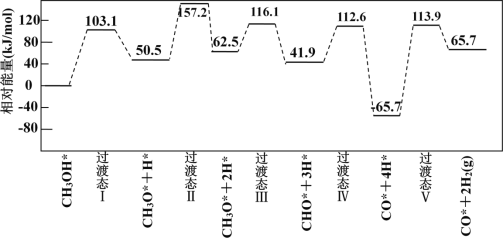
该历程中,放热最多的步骤的化学方程式为______________________________________________。
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol·L-1,则Ksp(PbI2)=_________。