题目内容
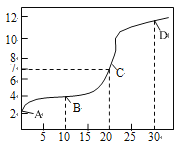
【题目】一定条件下,在体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)![]() Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是( )
Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是( )
A.将容器体积变为20L,Z的平衡浓度变为原来的一半
B.若增大压强,则物质Y的转化率减小
C.若升高温度,X的体积分数增大,则该反应的△H>0
D.以X浓度变化表示的反应速率为0.001mol/(L·s)
【答案】D
【解析】
根据题意可列出该反应至平衡时的三段式为:
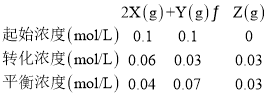
A.若体积变为20L,容器内压强将减小一半,平衡将逆向移动,最终平衡时,Z的浓度较原来的一半小,故A错误;
B.增大压强,平衡将会向气体体积减小的反应移动,即平衡正向移动,Y的转化率将增大,故B错误;
C.若升高温度,X的体积分数增大,说明平衡逆向移动,即逆向反应为吸热反应,因此该反应正向的△H<0,故C错误;
D.以X浓度变化表示的反应速率为![]() =0.001mol/(L·s),故D正确;
=0.001mol/(L·s),故D正确;
故答案为:D。

练习册系列答案
相关题目
【题目】25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3)![]() 0.1 mol/L
0.1 mol/L