题目内容
【题目】CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(一)①己知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ/mol,CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8 kJ/mol,
2CO(g)+O2(g)=2CO2(g)△H=-566.0 kJ/mol,
反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的△H=_____。
2CO(g)+2H2(g)的△H=_____。
②250℃时,以镍合金为催化剂,向2L容器中通入6mol CO2、6mol CH4,发生如下反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。2min后达到平衡,测得平衡体系中H2的体积分数为40%。此温度下该反应的平衡常数K=______。2min内CO2平均消耗速率为________。
2CO(g)+2H2(g)。2min后达到平衡,测得平衡体系中H2的体积分数为40%。此温度下该反应的平衡常数K=______。2min内CO2平均消耗速率为________。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
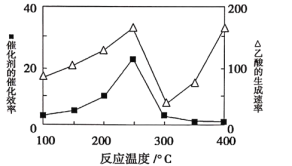
①在不同温度下催化剂的催化效率与乙酸的生成速率如下图所示。250~300℃时,乙酸的生成速率减小的原因是_________。
②为了提高该反应中CH4的转化率,可能采取的措施是__________________。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为_____________________。
(3)第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供动力,降低油耗;在刹车或下坡时,电池处于充电状态。混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH溶液)为电解质溶液。镍氢电池充放电原理示意图如下,其总反应式为H2+2NiOOH![]() Ni(OH)2。
Ni(OH)2。
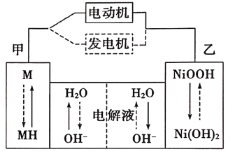
根据所给信息判断,混合动力车上坡或加速时,该电池处于________(选填“充电”或“放电”),乙电极的电极反应式为_________。
【答案】+247.3 kJ/mol 256 1mol/(L·min) 催化剂的催化效率降低 增大反应压强或增大CO2的浓度 3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O 放电 NiOOH+H2O+e-=Ni(OH)2+OH-
【解析】
(1)①根据盖斯定律来解答;
②先利用物质反应转化关系计算出各种物质的平衡浓度,带入平衡常数表达式计算可得其数值,根据速率含义计算出CO2的反应速率;
(2)①根据温度对催化剂活性的影响;
②根据外界条件对化学平衡的影响,平衡正向移动,反应物转化率增大;
③先将Cu2Al2O4拆成氧化物的形式:Cu2OAl2O3,再根据氧化物与酸反应生成离子方程式,需要注意的是一价铜具有还原性;
(3)上坡或加速时,该装置是原电池,根据图知,乙是镍的化合物为正极,正极上NiOOH得电子发生还原反应,据此书写电极反应式。
(1)①CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ/mol①
CO(g)+H2O(g)=CO2(g)+H2(g) △H=2.8kJ/mol ②
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol ③
根据盖斯定律,由①+②×2-③×2得,CO2(g)+CH4(g)2CO(g)+2H2(g) △H=-890.3kJ/mol+2.8kJ/mol×2+566.0kJ/mol×2=+247.3 kJ/mol;
②反应开始时,向2L容器中通入6mol CO2、6mol CH4,c(CO2)=c(CH4)=6mol÷2L=3mol/L,发生如下反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。2min后达到平衡,测得平衡体系中H2的体积分数为40%。假设CO2转化浓度为x,则同时会消耗CH4浓度为x,产生CO浓度为2x,产生H2浓度为2x,则平衡时各种物质的浓度:c(CO2)=c(CH4)=(3-x)mol/L,c(CO)=c(H2)=2x,由于测得平衡体系中H2的体积分数为40%,所以
2CO(g)+2H2(g)。2min后达到平衡,测得平衡体系中H2的体积分数为40%。假设CO2转化浓度为x,则同时会消耗CH4浓度为x,产生CO浓度为2x,产生H2浓度为2x,则平衡时各种物质的浓度:c(CO2)=c(CH4)=(3-x)mol/L,c(CO)=c(H2)=2x,由于测得平衡体系中H2的体积分数为40%,所以![]() =40%,解得x=2,所以此温度下该反应的平衡常数K=
=40%,解得x=2,所以此温度下该反应的平衡常数K=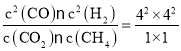 =256。2min内CO2平均消耗速率为v(CO2)=
=256。2min内CO2平均消耗速率为v(CO2)=![]() =1mol/(Lmin);
=1mol/(Lmin);
(2)①温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低;
②增大反应压强、增大CO2的浓度,平衡正向移动,反应物转化率增大;
③Cu2Al2O4拆成氧化物的形式:Cu2OAl2O3,与酸反应生成离子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O;
(3)上坡或加速时,该装置是原电池,根据图知,乙是镍的化合物为正极,正极上NiOOH和水得电子生成氢氧化镍和氢氧根离子,电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-,所以附近溶液中氢氧根离子浓度增大,溶液的pH值变大。

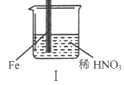
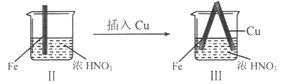
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
【题目】下表各组物质中,物质之间不可能实现如图所示转化的是( )
![]()
选项 | X | Y | Z | M |
A | NH3 | NO | NO2 | O2 |
B | Cl2 | FeCl3 | FeCl2 | Fe |
C | Al | Al(OH)3 | NaAlO2 | NaOH |
D | NaOH | Na2CO3 | NaHCO3 | CO2 |
A.AB.BC.CD.D