题目内容
【题目】金属锂及其化合物用途广泛。其在“氮的固定”中转化过程如图所示:
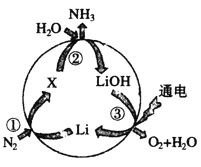
(1)图中X的化学式为__________。
(2)图中所示物质既含共价键、又含离子键的是_______(填化学式),属于电解质的有______种。
(3)③中阳极电极反应式为____________________。
(4)图中所示过程总转化关系式为_______________。
(5)Li也可用于空气中CO2的固定,其工作原理为:4Li+3CO2![]() 2Li2CO3+C。电池的电解质称为电池的“血液”,该电池的电解质应为_______________(填化学式)。正极电极反应式为_________________________________。反应中当有3mol氧化剂被还原,通过交换膜的Li+为_________mol。
2Li2CO3+C。电池的电解质称为电池的“血液”,该电池的电解质应为_______________(填化学式)。正极电极反应式为_________________________________。反应中当有3mol氧化剂被还原,通过交换膜的Li+为_________mol。
【答案】Li3N LiOH 3 4OH--4e-==2H2O+O2↑ 2N2+6H2O==4NH3+3O2 Li2CO3 3CO2+4e-==C+2CO32- 12
【解析】
(1)根据图中信息,锂和氮气反应得到答案。
(2)LiOH含有离子键和共价键, LiOH、NH3、Li3N是电解质。
(3)阳极是溶液中的氢氧根失去电子。
(4)根据图中信息得出氮气和水反应生成氨气和氧气,因此得总反应。
(5)根据电池工作原理分析得出负极为Li,正极为二氧化碳反应,电池的电解质称为电池的“血液”,该电池的电解质应为Li2CO3。正极电极反应式为3CO2 + 4e-= C+2CO32-,根据反应方程式中分析电子转移,再根据物质呈电中性原则,得到锂离子移动的物质的量。
(1)根据图中信息,锂和氮气反应生成氮化锂,因此X的化学式为Li3N,故答案为:Li3N。
(2)图中所示物质既含共价键、又含离子键的是LiOH,属于电解质的有LiOH、NH3、Li3N三种,故答案为:LiOH;3。
(3)③中是电解LiOH,因此阳极电极反应式为4OH--4e-==2H2O+O2↑,故答案为:4OH--4e-==2H2O+O2↑。
(4)根据图中信息得出氮气和水反应生成氨气和氧气,因此总转化关系式为2N2+6H2O = 4NH3 + 3O2,故答案为:2N2+6H2O = 4NH3 + 3O2。
(5)根据电池工作原理:4Li+3CO2![]() 2Li2CO3+C,分析得出负极为Li,正极为二氧化碳反应,电池的电解质称为电池的“血液”,该电池的电解质应为Li2CO3。正极电极反应式为3CO2 + 4e-= C+2CO32-,反应中3mol二氧化碳参与反应,转移4mol电子,只有1mol二氧化碳作氧化剂,因此反应中当有3mol氧化剂被还原,有12mol电子转移,有12mol负电荷,电荷守恒,因此通过交换膜的Li+为12mol,故答案为:3CO2 + 4e-= C+2CO32-;12。
2Li2CO3+C,分析得出负极为Li,正极为二氧化碳反应,电池的电解质称为电池的“血液”,该电池的电解质应为Li2CO3。正极电极反应式为3CO2 + 4e-= C+2CO32-,反应中3mol二氧化碳参与反应,转移4mol电子,只有1mol二氧化碳作氧化剂,因此反应中当有3mol氧化剂被还原,有12mol电子转移,有12mol负电荷,电荷守恒,因此通过交换膜的Li+为12mol,故答案为:3CO2 + 4e-= C+2CO32-;12。

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案