题目内容
3.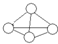 白磷分子如图所示,则31g白磷分子中存在的共价键数目是( )
白磷分子如图所示,则31g白磷分子中存在的共价键数目是( )(NA表示阿佛加德罗常数的值 磷的相对原子质量P-31)
| A. | 4NA | B. | NA | C. | 1.5NA | D. | 0.25NA |
分析 根据图知,每个白磷分子含有4个P原子,每个白磷分子中P-P键数目为6,n(P4)=$\frac{31g}{(31×4)g/mol}$=0.25mol,据此分析解答.
解答 解:根据图知,每个白磷分子含有4个P原子,每个白磷分子中P-P键数目为6,n(P4)=$\frac{31g}{(31×4)g/mol}$=0.25mol,31g白磷分子中存在的共价键数目=0.25mol×6×NA/mol=1.5NA,故选C.
点评 本题考查物质结构中化学键数目计算,侧重考查学生分析计算能力,注意白磷分子相对分子质量不是31,为易错点.

练习册系列答案
相关题目
13.下列离子方程式,正确的是( )
| A. | 过氧化钠与水反应:2O22-+2H2O═4OH-+O2↑ | |
| B. | 澄清石灰水中通入过量二氧化碳:OH-+CO2═HCO3- | |
| C. | 往FeCl3溶液中加入Cu粉:2Fe3++3Cu=2Fe+3Cu2+ | |
| D. | CaCO3溶于稀盐酸中:CO32-+2H+═CO2↑+H2O |
14.下列反应的离子方程式正确的是( )
| A. | 铁跟氯化铁溶液反应:Fe+2Fe3+=3Fe2+ | |
| B. | 氨水跟盐酸反应:OH-+H+→H2O | |
| C. | 氢氧化钡跟稀硫酸反应:Ba2++OH-+H++SO42-→BaSO4↓+H2O | |
| D. | 碳酸钙跟盐酸反应:CO32-+2H+→CO2↑+H2O |
11.在恒温恒容的密闭容器中,对于可逆反应A(g)+B(g)?2C(g)+D(S),可以判断达到化学平衡状态的是( )
| A. | 体系压强不变 | |
| B. | 单位时间消耗n molA,同时生成2nmolC | |
| C. | 容器内气体密度不变 | |
| D. | A、B、C、D的反应速率之比为1:1:2:1 |
8.已知Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O把下列四种Na2S2O3溶液分别加入四个盛有10mL 2mol/L硫酸的锥形瓶中,并加水稀释到50mL,其中出现浑浊最快的是( )
| A. | 20℃,20mL、3mol/L的Na2S2O3溶液 | B. | 10℃,10mL、4mol/L的Na2S2O3溶液 | ||
| C. | 10℃,30mL、2mol/L的Na2S2O3溶液 | D. | 20℃,10mL、4mol/L的Na2S2O3溶液 |
15. 一定温度下,向容积为2L的恒容密闭容器中充入6mol CO2和8mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线Ⅰ所示.下列说法正确的是( )
一定温度下,向容积为2L的恒容密闭容器中充入6mol CO2和8mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线Ⅰ所示.下列说法正确的是( )
 一定温度下,向容积为2L的恒容密闭容器中充入6mol CO2和8mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线Ⅰ所示.下列说法正确的是( )
一定温度下,向容积为2L的恒容密闭容器中充入6mol CO2和8mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线Ⅰ所示.下列说法正确的是( )| A. | 该反应在0~8 min内CO2的平均反应速率是 0.375 mol•L-1•min-1 | |
| B. | 若起始时向上述容器中充入3 mol CO2和4 mol H2,则平衡时H2的体积分数大于20% | |
| C. | 若起始时向上述容器中充入4 mol CO2、2 mol H2、2 mol CH3OH和1mol H2O(g),则此时反应向正反应方向进行 | |
| D. | 改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气 |
 .
.
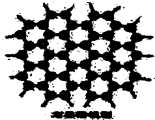 石墨晶体是层状结构,在每一层里,每一个碳原子都跟其它3个碳原子相结合.如图是石墨的晶体结构俯视图,图中每个黑点表示1个碳原子,而两黑点间的连线表示1个共价键,则石墨晶体中碳原子个数与共价键个数之比为( )
石墨晶体是层状结构,在每一层里,每一个碳原子都跟其它3个碳原子相结合.如图是石墨的晶体结构俯视图,图中每个黑点表示1个碳原子,而两黑点间的连线表示1个共价键,则石墨晶体中碳原子个数与共价键个数之比为( )