题目内容
15.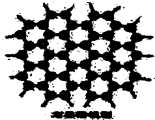 石墨晶体是层状结构,在每一层里,每一个碳原子都跟其它3个碳原子相结合.如图是石墨的晶体结构俯视图,图中每个黑点表示1个碳原子,而两黑点间的连线表示1个共价键,则石墨晶体中碳原子个数与共价键个数之比为( )
石墨晶体是层状结构,在每一层里,每一个碳原子都跟其它3个碳原子相结合.如图是石墨的晶体结构俯视图,图中每个黑点表示1个碳原子,而两黑点间的连线表示1个共价键,则石墨晶体中碳原子个数与共价键个数之比为( )| A. | 1:3 | B. | 2:3 | C. | 2:1 | D. | 3:2 |
分析 利用均摊法计算碳原子占有的C-C化学健个数,每个碳原子与其占有的C-C化学健之比即是石墨晶体每一层内碳原子与C-C化学健之比,据此分析解答.
解答 解:六边形中由6个C原子,每个碳原子被3个六边形共用,则一个六边形占有的碳原子数目是6×$\frac{1}{3}$=2,占有的碳碳单键数目是6×$\frac{1}{2}$=3,所以碳原子数与碳碳单键数之比为2:3,
故选:B.
点评 本题考查了晶胞的有关知识,明确每个碳原子占有的碳碳化学键个数是解本题的关键,根据均摊法来分析解答即可,难度不大.

练习册系列答案
相关题目
3.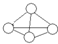 白磷分子如图所示,则31g白磷分子中存在的共价键数目是( )
白磷分子如图所示,则31g白磷分子中存在的共价键数目是( )
(NA表示阿佛加德罗常数的值 磷的相对原子质量P-31)
 白磷分子如图所示,则31g白磷分子中存在的共价键数目是( )
白磷分子如图所示,则31g白磷分子中存在的共价键数目是( )(NA表示阿佛加德罗常数的值 磷的相对原子质量P-31)
| A. | 4NA | B. | NA | C. | 1.5NA | D. | 0.25NA |
3.能够测定有机物分子中化学键和官能团的是( )
| A. | 质谱 | B. | 红外光谱 | C. | 紫外光谱 | D. | 核磁共振谱 |
10.元素周期表的一部分,回答下列问题(用元素符号填写):
(1)分别写出①、③两种元素形成的高价态化合物的电子式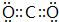
(2)写出⑨的原子结构示意图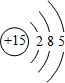 .
.
(3)在这些元素中,最活泼的金属元素的最高价氧化物对应水化物的电子式为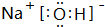 含有化学键为离子键、共价键
含有化学键为离子键、共价键
(4)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;形成两性氢氧化物的化学式是Al(OH)3;上述两者反应的离子方程式Al(OH)3+3H+═Al3++3H2O
(5)从⑤到(11)的元素中,Cl原子半径最小.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VIIA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | (10) | (11) | (12) |
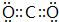
(2)写出⑨的原子结构示意图
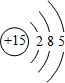 .
.(3)在这些元素中,最活泼的金属元素的最高价氧化物对应水化物的电子式为
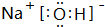 含有化学键为离子键、共价键
含有化学键为离子键、共价键(4)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;形成两性氢氧化物的化学式是Al(OH)3;上述两者反应的离子方程式Al(OH)3+3H+═Al3++3H2O
(5)从⑤到(11)的元素中,Cl原子半径最小.
20.按碳骨架分类,下列说法正确的是( )
| A. | 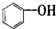 属于醇类化合物 属于醇类化合物 | B. | 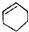 属于芳香族化合物 属于芳香族化合物 | ||
| C. | CH3CH(CH3)2属于链状化合物 | D. |  属于脂环化合物 属于脂环化合物 |
7.Y、Z三种金属,X、Y组成原电池,X是负极;把Z放入X的硝酸盐溶液中,Z表面有X析 出.三者的金属活动性顺序是( )
| A. | X>Y>Z | B. | Z>X>Y | C. | X>Z>Y | D. | Y>X>Z |
5. 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有极其广泛的应用.
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有极其广泛的应用.
(一)用铁屑与硫酸反应制备FeSO4
已知4Fe2++O2+4H+=4Fe3++2H2O.FeSO4在水中的溶解度见图.
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.此步骤中,分离出液体的方法通常不用过滤,使用的操作是倾析法(填写操作名称).
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得FeSO4溶液.温度宜控制在60℃左右;加热的同时需适当补充水,原因是防止硫酸亚铁晶体析出.反应中应保持n(Fe)/n(H2SO4)>1(填“<”、“>”或“=”).
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在.如“摩尔盐”,即硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O],就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得.过程中稀硫酸的作用是防止硫酸亚铁水解.
(二)用含有少量Al的废铁屑制备Fe2(SO4)3其操作流程及有关资料如下:

(4)加NaHCO3时,混合液pH值应控制在4.4-7.5之间.
(5)反应Ⅱ中反应的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
(6)实际生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是节约Fe(NO3)3、防止NO污染,气体X与NO配比的比例是3:4.
 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有极其广泛的应用.
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有极其广泛的应用.(一)用铁屑与硫酸反应制备FeSO4
已知4Fe2++O2+4H+=4Fe3++2H2O.FeSO4在水中的溶解度见图.
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.此步骤中,分离出液体的方法通常不用过滤,使用的操作是倾析法(填写操作名称).
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得FeSO4溶液.温度宜控制在60℃左右;加热的同时需适当补充水,原因是防止硫酸亚铁晶体析出.反应中应保持n(Fe)/n(H2SO4)>1(填“<”、“>”或“=”).
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在.如“摩尔盐”,即硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O],就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得.过程中稀硫酸的作用是防止硫酸亚铁水解.
(二)用含有少量Al的废铁屑制备Fe2(SO4)3其操作流程及有关资料如下:

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 2.3 | 7.5 | 3.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 4.4 |
(5)反应Ⅱ中反应的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
(6)实际生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是节约Fe(NO3)3、防止NO污染,气体X与NO配比的比例是3:4.
