题目内容
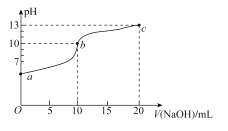
【题目】连二次硝酸(H2N2O2)是一种二元酸。常温下,向10 mL 0.01 mol·L-1的H2N2O2溶液中滴加0.01 mol·L-1的NaOH溶液,测得H2N2O2溶液pH与NaOH溶液体积的关系如图所示。下列说法不正确的是

A.由a点到n点水的电离程度依次增大
B.a点时,c(H2N2O2)>c(Na+)
C.m点时,c(OH-)+c(N2O22-)=c(H2N2O2)+c(H+)
D.m点到n点,![]() 比值不变
比值不变
【答案】B
【解析】
根据题中H2N2O2溶液pH与NaOH溶液体积的关系如可知,本题考查酸碱混合时的定性判断及有关ph的计算,运用盐类水解原理,溶液中的守恒思想和H2N2O2的电离平衡常数分析。
连二次硝酸(H2N2O2)是一种二元酸。常温下,向10mL0.01mol/L的H2N2O2溶液滴加0.01mol/L的NaOH溶液,起始时,酸的pH为4.3,若H2N2O2为强酸,则pH=2,可见H2N2O2为弱酸,其盐会发生水解,水解促进水的电离,酸电离抑制水的电离,
A. 从a到n点,随着NaOH溶液的不断加入, H2N2O2的量不断减小,对水的抑制作用不断减小,NaHN2O2和Na2N2O2的量不断增多,水解促进水的电离,则由a点到n点,水的电离程度不断增大,故A正确;
B.a点时,加入NaOH溶液的体积为5mL,此时溶液中的起始组分为c(NaHN2O2)=c(H2N2O2),根据物料守恒,2c(Na+)=c(HN2O2)+c(H2N2O2),变化为c(Na+)c(HN2O2)=c(H2N2O2)c(Na+),根据电荷守恒,c(Na+)+c(H+)=c(OH)+c(HN2O2),由于溶液显酸性,则c(H+)>c(OH),所以c(Na+)<c(HN2O2),因此c(H2N2O2)<c(Na+),故B错误;
C.m电时,加入NaOH溶液的体积为10mL,此时溶液中的起始组分恰好为NaHN2O2,根据质子守恒,c(OH)+c(N2O22)=c(H2N2O2)+c(H+),故C正确;
D.HN2O2的电离平衡常数为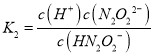 ,溶液中Kw=c(H+)c(OH),则
,溶液中Kw=c(H+)c(OH),则![]() ,比值只随温度的改变而改变,则从m点到n点,比值不变,故D正确;
,比值只随温度的改变而改变,则从m点到n点,比值不变,故D正确;
答案选B。

【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS 等)来制备,其工艺流程如下:

回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为_________________________;
(2)“溶解”时放出的气体为_______________ (填化学式);
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为______________________;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式_____________;

(5)金属铬在溶液中有多种存在形式, CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应________________,根据A点数据计算出该转化反应的平衡常数为______________,温度升高,溶液中CrO42—的平衡转化率减小,则该反应的△H____0(填“>”、“<”或“=”)。