题目内容
【题目】苯乙烯是一种重要的化工原料,世界卫生组织国际癌症研究机构公布的致癌物清单初步整理参考,苯乙烯在2B类致癌物清单中。
(1)工业上可用乙苯催化脱氢方法制备苯乙烯,其反应原理如下:
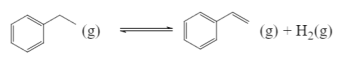
①在容积固定为2L的密闭容器内充人2mol![]() ,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,用压力计监测容器内压强的变化如下:
,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 12.6 | 13.68 | 14.55 | 15.22 | 15.6 | 15.75 | 15.75 |
根据表中数据计算该温度下压强平衡常数Kp_____(计算结果带单位,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②实际生产中常在恒压条件下掺入高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应)。在一定压强、900K的条件下,苯乙烯的产率随着![]() 的增大而_________(填“增大”“减小”或“不变”)。随着反应的进行,会产生积碳使催化剂活性减弱,水蒸气还有利于恢复催化剂活性,原因是__________(用化学方程式表示)。
的增大而_________(填“增大”“减小”或“不变”)。随着反应的进行,会产生积碳使催化剂活性减弱,水蒸气还有利于恢复催化剂活性,原因是__________(用化学方程式表示)。
(2)研究表明金属次卟啉二甲酯能够顺利地选择性催化氧化苯乙烯生成苯甲醛(结构简式为![]() ),以该反应原理设计成酸性燃料电池,则电池负极的电极反应式为____________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上转移电子的物质的量为________。
),以该反应原理设计成酸性燃料电池,则电池负极的电极反应式为____________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上转移电子的物质的量为________。
【答案】1.05 MPa 增大 ![]()
![]() —8e- +3H2O=
—8e- +3H2O=![]() +CO2↑+8H+ 2 mol
+CO2↑+8H+ 2 mol
【解析】
(1)①根据方程式计算平衡时各组分的分压,代入分压平衡常数表达式计算Kp的值;
②恒压下,加入水蒸气稀释剂,相当于增大容器体积,高温下,水蒸气可与碳反应;
(2)负极发生氧化反应,苯乙烯被氧化生成苯甲醛;若该电池消耗标准状况下11.2L的O2,即0.5mol氧气,反应中O元素化合价由0价降低为-2价,则转移2mol电子。
(1)①反应前充入体系中的![]() (EB)的物质的量2mol,
(EB)的物质的量2mol,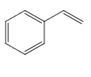 (ST)的物质的量为0,可列三段式
(ST)的物质的量为0,可列三段式
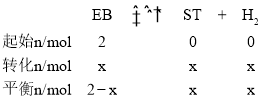
相同状况下,气体压强之比与气体物质的量成正比,因此可列式
![]() ,解得x=0.5,
,解得x=0.5,
则该条件下的压强平衡常数为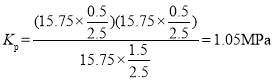 ;
;
②恒压条件下,增加水蒸气的n,导致体系V增大,使平衡正向移动,使苯乙烯的产率随着![]() 的增大而增大,水蒸气能与C反应,从而减少积碳,有利于恢复催化剂活性,原因是
的增大而增大,水蒸气能与C反应,从而减少积碳,有利于恢复催化剂活性,原因是![]() ;
;
(2)苯乙烯作电池的负极,产物为苯甲醛,电极反应式为![]() —8e- +3H2O=
—8e- +3H2O=![]() +CO2↑+8H+;若该电池消耗标准状况下11.2 L的O2,则外电路中理论上转移电子的物质的量为2mol。
+CO2↑+8H+;若该电池消耗标准状况下11.2 L的O2,则外电路中理论上转移电子的物质的量为2mol。